Het Anabolenboek
Willem Koert
Aede de Groot
Wageningen, 11/11/2006
6. Hoe communiceren moleculen met elkaar?
Aede de Groot, Willem Koert
Als twee moleculen samen een complex vormen, zoals een steroidhormoon met zijn receptor, dan moet het steroidhormoon weten welk eiwit in de celvloeistof zijn hoogsteigen receptor is. De moleculen moeten op een of andere manier met elkaar communiceren. Ze moeten aanvoelen dat ze bij elkaar passen. Chemici zeggen dan dat de moleculen een goede interactie of wisselwerking met elkaar hebben, die resulteert in binding van een hormoon met zijn receptor. Dit hoofdstuk gaat over de soorten interacties die moleculen met elkaar kunnen aangaan.
De belangrijkste soorten interacties die een rol spelen bij de binding van een ligand aan zijn receptor zijn dipool-dipool interacties, apolaire interacties, waterstofbruggen en ion-interacties (zoutbruggen).
Voor een goed begrip van interacties op moleculair niveau moeten we even terug gaan naar de eenvoudige koolstofmoleculen van hoofdstuk 2. Er is daar al gesproken over de bouw van het molecuul, nu moeten we iets leren over de binding in die moleculen, en over de ladingsverdeling in die binding.
Moleculen zijn opgebouwd uit atomen. Die atomen bestaan uit een atoomkern met daarin positief geladen protonen en neutrale neutronen. Protonen en neutronen zijn ongeveer even zwaar en meer dan 99% van de massa van een atoom zit in de kern. Op relatief grote afstand om de atoomkern cirkelen de negatief geladen electronen daar razendsnel omheen. Een atoom in zijn geheel is neutraal. Er cirkelen evenveel electronen rondom de kern als er protonen zitten in de kern. De electronen zorgen voor de binding tussen de atomen tot moleculen.
De bindingen in organische moleculen zijn covalente bindingen. Een bindend electronenpaar dat tussen de beide atoomkernen zit, zorgt voor binding. Elk atoom aan weerskanten van de binding levert één electron voor dit bindende electronenpaar. In bindingen tussen dezelfde atomen, zoals de C-C binding in ethaan, zit dat bindende electronenpaar in het midden tussen de beide atoomkernen. Dit is echter niet het geval bij een binding tussen verschillende atomen. Daar trekt het atoom met de meeste positief geladen protonen in zijn kern het electronenpaar een beetje naar zijn kant. Een groter aantal protonen maakt een atoom meer electronegatief, dat wil zeggen dat zo’n atoom een grotere aantrekking op de negatief geladen electronen in de binding uitoefent.
|
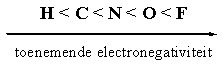
In steroiden hebben we vooral te maken met C-C bindingen, met C-H bindingen en met C-O bindingen en soms met C-N bindingen en C-F bindingen. De electronegativiteit van de atomen in die bindingen neemt toe in de hiernaast aangegeven volgorde. Fluor is het meest electronegatieve atoom dat we kennen.
Een C-atoom is een beetje meer electronegatief dan een H-atoom. De electronen in een C-H binding zitten dus een beetje meer naar de kant van het C-atoom en dat is daardoor een klein beetje negatief geladen. We geven dat aan met het teken δ-. Het H-atoom is een klein beetje positief geladen en dat is aangegeven met het teken δ+. Deze individuele C-H binding krijgt daardoor een kleine dipool. In een dipool vallen de centra van positieve en negatieve lading niet meer samen. Een dipool wordt aangegeven met een pijl waarvan de punt wijst in de richting van de negatieve lading. We kunnen een dipool vergelijken met een klein magneetje met een plus- en een min-pool.
Een afzonderlijke binding in een molecuul kan een dipool hebben, maar dat hoeft nog niet te betekenen dat ook het hele molecuul een dipool heeft. Dit hangt namelijk ook af van de bouw van het molecuul. In moleculen zoals methaan, ethaan en CO2, zijn de individuele bindingen alle polair, maar door de bouw van het hele molecuul is de richting van de afzonderlijke dipolen zo dat het gezamenlijke resultaat, de resultante, nul is. De hele moleculen hebben dan geen dipool en we noemen zulke verbindingen apolair (zie Figuur 1).
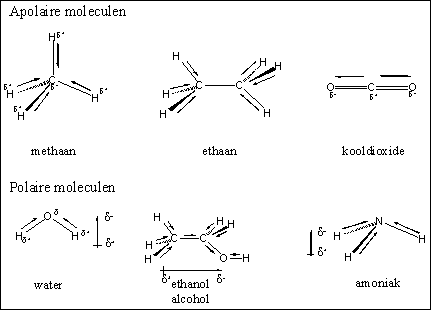
Figuur 1
In andere moleculen waarin de afzonderlijk bindingen een dipool hebben is de resultante van die individuele dipolen niet nul. Die moleculen hebben dus als geheel ook een dipool en dat soort moleculen noemen we polair. Dit is het geval in de moleculen water, ethanol en ammoniak en dat zijn dus polaire moleculen.
Als we kijken naar de onderlinge interactiemogelijkheden tussen de verschillende soorten moleculen, dan geldt daar de simpele wet: soort zoekt soort. Dus apolaire moleculen hebben graag interactie met andere apolaire moleculen en polaire moleculen zoeken graag interactie met andere polaire moleculen. Moleculen met veel CH2- en CH3-groepen hebben geen of heel kleine dipolen. Zulke moleculen of zulke gedeelten van grotere moleculen zijn apolair. Moleculen of gedeelten daarvan met veel OH-groepen (hydroxylgroepen) of veel C=O-groepen (carbonylgroepen) zijn polair.
Voor polaire moleculen is het niet moeilijk de aard van hun interactie vast te stellen. De positieve kant van het ene molecuul wordt aangetrokken door de negatieve kant van het andere molecuul en omgekeerd. Dit noemen we een dipool-dipool-interactie en die berust op de electrostatische interactie tussen tegengesteld geladen delen van de moleculen. Dit is vergelijkbaar met de aantrekking tussen de tegengestelde polen twee magneten (zie Figuur 2).
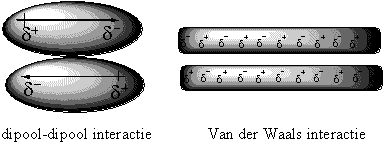
Figuur 2
Voor apolaire moleculen is het lastiger aan te geven waarom zij interactie met elkaar hebben. Deze interactie is een gevolg van de Van der Waals-krachten. Dit zijn zwakke elkaar aantrekkende intermoleculaire krachten die berusten op tijdelijke en plaatselijke elkaar aantrekkende dipool-dipool interacties (zie Figuur 2).
Van der Waals-krachten werken tussen alle moleculen. Het bestaan van deze aantrekkende krachten kan afgeleid worden uit het feit dat alle stoffen vloeibaar kunnen worden, dus ook gassen als methaan en kooldioxide. Bij voldoende lage temperatuur winnen de Van der Waals-krachten het uiteindelijk van de kinetische energie van de warmtebeweging en dan condenseren de moleculen tot een vloeistof. De aantrekking tussen moleculen met veel apolaire CH2- en CH3-groepen berust geheel op Van der Waals-krachten en in dat soort moleculen wordt het ook apolaire interactie genoemd.
Als apolaire moleculen interactie met elkaar hebben in een water omgeving, heet het ook wel hydrofobe interactie. Deze laatste term geeft aan dat in een waterige omgeving de apolaire stoffen elkaar opzoeken en geen interactie met het polaire water willen. Je kunt het ook andersom zien. De polaire watermoleculen willen zo graag interactie met elkaar hebben dat ze het vervelend vinden als daar apolaire stoffen tussen zitten die hun onderlinge interactie belemmeren. De apolaire stoffen zoeken hun heil dan maar bij elkaar. In het biologische milieu van de cel, wat bestaat uit water, is dit een belangrijk type interactie.
Van der Waals-krachten werken tussen moleculen, en deze krachten zijn sterker naarmate het oppervlak van de moleculen groter is. Een groter molecuul heeft meestal ook een groter oppervlak en daardoor een betere interactie met zijn buurman. Daarom is de vorm van een molecuul belangrijk voor een goede interactie. Lineaire moleculen hebben een groter oppervlak dan bolvormige moleculen met hetzelfde gewicht. De lineaire moleculen oefenen daardoor meer aantrekkende Van der Waals-krachten op elkaar uit waardoor de onderlinge interactie sterker is. Een groter contactoppervlak verbetert dan ook de interactie tussen een steroidhormoon en zijn receptor. In hoofdstuk 7 gaan we daar dieper op in.
Figuur 3 |
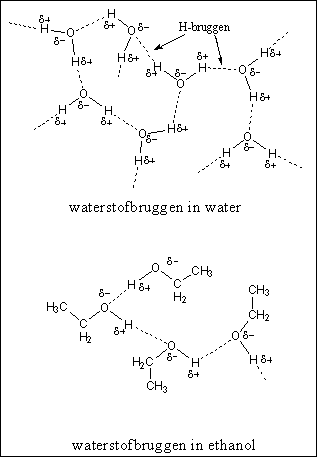
Een derde soort interactie is de waterstofbrug, of kortweg de H-brug. Een waterstofbrug is een relatief sterke vorm van interactie vergeleken met de bovengenoemde dipool-dipool-interactie en de apolaire interactie. Een waterstofbrug heeft ongeveer vijf procent van de sterkte van een gewone binding tussen twee atomen. Een waterstofbrug is een zwakke binding tussen een H-atoom dat gebonden is aan een O-atoom of een N-atoom in het ene molecuul, met een O-atoom of een N-atoom van een ander molecuul. Waterstofbruggen ontstaan op deze manier in water, alcoholen en amiden (bijvoorbeeld tussen peptide-bindingen) (zie Figuur 3 en 4). Zwakkere waterstofbruggen ontstaan in ammoniak en aminen.
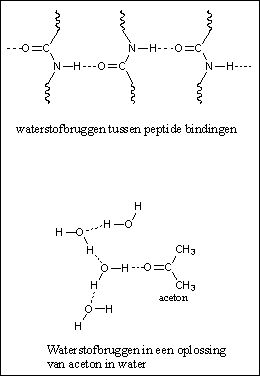
Figuur 4 |
Een molecuul kan een H-brug-donor, een H-brug-acceptor, of allebei zijn. In water en alcohol zijn de moleculen zowel donor (met de H aan de O) als acceptor (met de O aan de H). In een peptide binding is de aminogroep met de H aan de N alleen een donor en de carbonylgroep alleen een acceptor. Dat laatste is logisch. Er zitten gewoon geen H-atomen aan een carbonylgroep die gedoneerd kunnen worden. Een carbonylgroep is altijd alleen maar een H-brug-acceptor. Hiernaast is dat getoond voor een oplossing van aceton in water (zie Figuur 4).
Een vierde soort interactie is de electrostatische interactie tussen positief en negatief geladen ionen. Dit zijn ion-interacties of zoutbruggen (zie Figuur 5). Een ion is een atoom of een molecuul waarin een electron meer of een electron minder rond de kern cirkelt dan het aantal protonen dat in de kern zit.
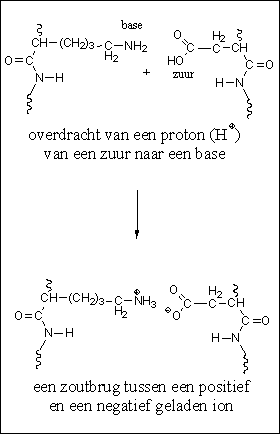
Figuur 5 |
Als er een electron minder aanwezig is dan is het ion positief geladen. Er is dan een proton te veel aanwezig in het geheel, en zo’n positief geladen ion noemen we een kation. Als er een electron te veel rond de kern cirkelt, dan is het ion als geheel negatief geladen. Dan noemen we het een anion.
De overdracht van een positief geladen H-atoom (een proton, of H+), van de zuurgroep van een carbonzuur naar een basische aminogroep, geeft ook negatief en positief geladen ionen. Dit proces treedt op in de zijketens van de zure en basische aminozuren die deel uitmaken van het eiwit. Dit leidt tot vorming van positieve en negatieve ionen waartussen een electrostatische aantrekking optreedt. Die aantrekkende kracht speelt een rol bij het opvouwen van de eiwitketen.
Alle genoemde interacties treden op tussen de peptide bindingen in de keten van een eiwit, en tussen de zijstaarten van de samenstellende aminozuren. Daardoor vouwt die eiwitketen zich op tot een losse kluwen. Al die genoemde interacties treden ook op tussen die zijstaarten van de aminozuren en andere moleculen, bijvoorbeeld anabole steroïden, waarmee het eiwit een complex vormt. In het volgende hoofdstuk zullen we bespreken hoe die interactie plaatsvindt tussen anabole steroiden en de androgeenreceptor.
|
|