Het Anabolenboek
Willem Koert
Aede de Groot
Wageningen, 25/10/2008
21. De Echte Anabole Steroïden
Aede de Groot, Willem Koert
In de vorige hoofdstukken hebben we aandacht geschonken aan prohormonen, hormoonderivaten en designersteroïden. Hoewel we in dit Anabolenboek al veel echte anabole steroïden de revue hebben laten passeren hebben we die middelen nog niet behandeld in een eigen hoofdstuk. Dat doen we nu.
Het hoogtepunt van de steroidchemie ligt tussen 1950 en 1970. De aandacht in de farmaceutische industrie ging toen vooral uit naar de ontwikkeling van steroïden voor het bestrijden van hormonale afwijkingen, voor hormoontherapie, het bestrijden van overgangsklachten, anticonceptie, en het bestrijden van bloedarmoede, osteoperose en prostaat- en borstkanker. Daarbij is vaak langdurig gebruik van steroïden noodzakelijk. Het is dan ook belangrijk dat er zo weinig mogelijk bijwerkingen optreden. Bovendien mag de toediening comfortabel zijn, bij voorkeur als pil. De steroïden moeten een lange werkingsduur hebben en metabole inactivering mag dus niet te snel optreden. Ook sporters houden van langwerkende steroïden, maar voor hen staat de anabole activiteit van de middelen voorop.
De farmaceutische industrie heeft in de loop der jaren honderden anabole steroïden gemaakt, in een voortdurende poging het ideale anabole steroid te vinden. Van die honderden anabole steroïden zijn er een paar honderd goed getest en gepatenteerd. Veel daarvan zijn op de markt gebracht en weer verdwenen - en vaak in het illegale circuit terecht gekomen.
Van dit grote aantal anabole steroïden behandelen we in dit hoofdstuk slechts een beperkt aantal. Aan ons keuzeproces lagen twee overwegingen ten grondslag. De eerste is dat bodybuilders en andere krachtsporters grote belangstelling hebben voor anabole steroïden. Daar zijn boeken over geschreven, vooral voor gebruikers. De meest gebruikte zijn die van Duchaine [1] en Llewellyn [2]. De middelen die daarin staan hebben we hier opgenomen.
Ook wedstrijdsporters hebben grote belangstelling voor anabole steroïden. Om competitievervalsing te voorkomen zijn anabolen in de wedstrijdsport verboden. Door de World Anti Doping Autoriteit (WADA) zijn lijsten gepubliceerd van die verboden anabole steroïden. [3] Ook de middelen op die lijsten hebben we hier opgenomen. Daar hebben we het bij gelaten.
Het subtiele onderscheid tussen steroïden in voedingsupplementen en echte anabole steroïden is in de vorige hoofdstukken al ter sprake gekomen. Veel prohormonen en steroïden in voedingsupplementen zijn gewoon echte anabolen. De WADA laat zich minder gemakkelijk om de tuin leiden dan overheden of gebruikers en heeft veel van die steroïden op de lijst van verboden stoffen geplaatst. Die verwevenheid tussen steroïden in voedingsupplementen en echte anabole steroïden hebben we in dit hoofdstuk zichtbaar gemaakt.
Dat is gedaan met een code onder de structuurformule van alle steroïden die in een voedingsupplement te koop zijn en ook op de verboden lijst van de WADA staan. Voor het steroid in een voedingsupplement is daarvoor het nummer van dat steroid in het betreffende hoofdstuk gebruikt. Het voorkomen van het steroid op de WADA-lijst is aangegeven door de naam in rood weer te geven. Het blijkt dat van de tachtig echte anabole steroïden er twintig in voedingssupplementen te koop zijn en ook op de lijst van verboden steroïden van de WADA staan. We hebben daarbij alleen gekeken naar het basismolecuul (bijvoorbeeld nandrolon) terwijl we alle derivaten (bijvoorbeeld nandrolonesters) buiten beschouwing hebben gelaten.
Die tachtig echte anabole steroïden in dit hoofdstuk maken een onderverdeling noodzakelijk. We hebben gekozen voor eenzelfde onderverdeling als in Hoofdstuk 19. Grote groepen zijn voor de duidelijkheid verder onderverdeeld, op basis van hun chemische structuurkenmerken.
We komen dan tot de volgende elf groepen.
1. Testosteron-achtige steroïden
2. 19-Nor-androstenen
3. 17a-Methylandrostenen
4. 19-Nor-17a-methyl- en -ethyl-androstenen
5. Dihydrotestosteron-achtige steroïden
6. D1-Testosteron-achtige steroïden
7. Androstenen met meerdere dubbele bindingen
8. De 19-nor- en de 17a-methyl-analoga van steroïden
met meerdere dubbele bindingen
9. Steroïden met een hydroxylgroep op C4
10. Chloorbevattende steroïden
11. Steroïden met een heterocyclische ring aan ring A
Groep 1. Testosteron-achtige steroïden
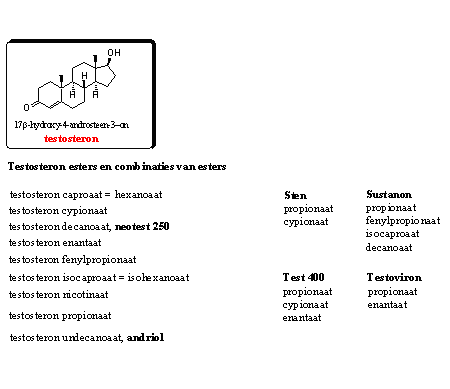
Testosteron zelf en een hele reeks esters daarvan zijn te koop als anabole preparaten. In Hoofdstuk 16 hebben we die esters behandeld. Testosteron metaboliseert snel, en daarom zijn esters populairder bij gebruikers. Esters zorgen voor een verhoogde testosteronspiegel gedurende langere tijd dankzij een geleidelijke hydrolyse door esterases in het bloed.
Het lichaam produceert zelf endogene anabole steroïden. Dit zijn de normale tussenproducten en eindproducten in de biosynthese van testosteron.
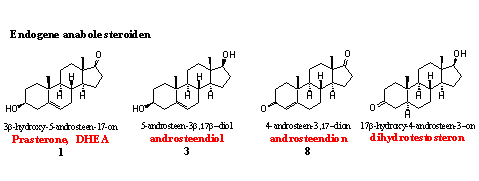
Als dopingjagers afwijkingen van de normale concentraties van deze steroïden vinden bij wedstrijdsporters, dan beschouwt de WADA dit als een positief dopinggeval. Dat is ook zo als de dopingjagers kunnen aantonen dat het steroid is toegediend, en van “exogene oorsprong” is. Het bovenstaande geldt voor alle onderstaande metabolieten van endogene anabole steroïden.
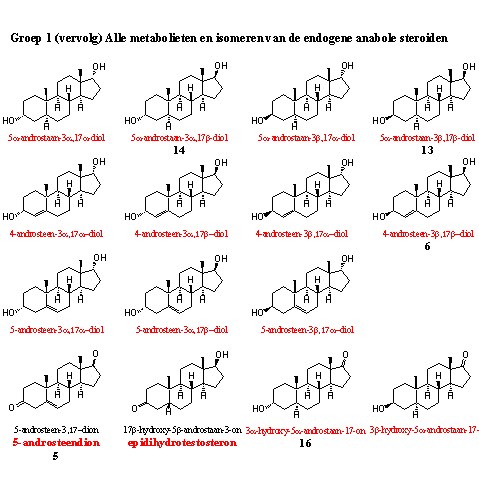
In deze groep tussenproducten en metabolieten zitten al acht steroïden die ook in voedingsupplementen zijn opgedoken. Of deze steroïden nu wel of niet werken, of enzymen in het lichaam ze nu wel of niet in een echt anabool omzetten, dat doet er voor de WADA niet toe, afwijkende concentraties van deze steroïden zijn verdacht. Wedstrijdsporters die regelmatig dopingcontroles ondergaan moeten deze prohormonen niet gebruiken.
Groep 2. 19-Nor-androstenen
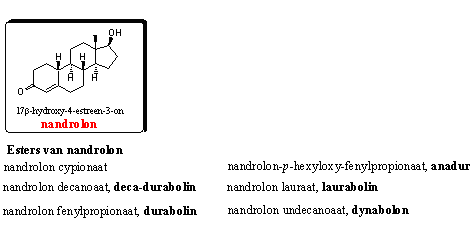
Nandrolon en veel van zijn esterderivaten hebben goede anabole eigenschappen. Nandrolon-esters hebben, net als testosteron-esters, een langere werkingsduur. [4] Ook de nandrolon-esters zijn in Hoofdstuk 16 besproken.
Nandrolon kan in principe aromatiseren maar dat gebeurt slechts in geringe mate en onder speciale omstandigheden. Nandrolon aromatiseert niet via het gewone aromatiseringsproces - door het enzym aromatase - omdat de C19-methylgroep ontbreekt.
Reductie van de D4-dubbele binding tot dihydronandrolon, door het enzym 5AR, verloopt op dezelfde manier als bij testosteron. De androgene activiteit van dihydronandrolon en zijn analoga is minder dan die van de overeenkomstige dihydrotestosteronsteroïden. Dit betekent dat in weefsels waar 5AR actief is en dihydronandrolon vormt minder bijwerkingen optreden. Nandrolon heeft daardoor een gunstiger verhouding tussen anabole en androgene activiteit dan testosteron.
De vier onderstaande nandrolon-analoga en metabolieten staan op de dopinglijst van de WADA. De eerste twee zijn ook als prohormoon voor nandrolon verschenen als supplement. Ze zijn besproken in Hoofdstuk 19.
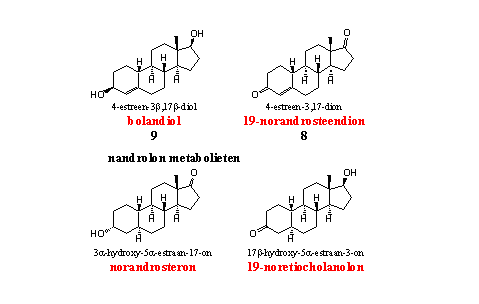
Dopingjagers gebruiken de twee voornaamste metabolieten van nandrolon, norandrosteron en 19-nor-etiocholanon, om misbruik van het anabool op te sporen. Er is al opgemerkt dat nandrolon in zeer kleine hoeveelheden een lichaamseigen steroid kan zijn. Het is een nevenproduct van de aromatisering van testosteron en androsteendion naar estradiol en estradion. De limieten die het IOC daarvoor hanteert zijn nog steeds onderwerp van discussie. [5].
Groep 3. 17a-Methyl-androstenen
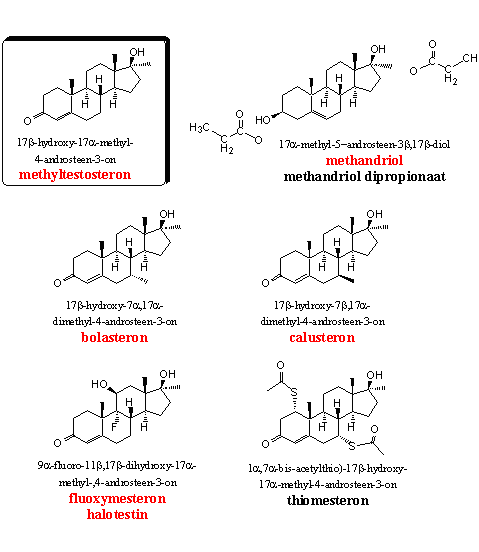
De steroïden in Groep 3 hebben allemaal een 17a-methylgroep. Deze groep maakt de oxidatie van de 17b-hydroxylgroep onmogelijk en hindert oxidatie op C16. Door de toegenomen sterische hinder is ook een reactie met glucuronzuur of sulfaat lastiger zodat deze steroïden minder snel uit het lichaam verdwijnen. De 17a-methyl-anabolen zijn daardoor oraal beschikbaar. Je kunt ze gebruiken in pilvorm.
Methyltestosteron is het basismolecuul van deze groep. We hebben dit steroid niet in voedingssupplementen aangetroffen. Het prohormoon voor methyltestosteron (methyl-4AD, Hoofdstuk 19, steroid 12) zit wel in een voedingsupplement. Methyltestosteron is een gewoon anabool steroid en behoort tot de eerste 17a-methylsteroïden die op de markt zijn gekomen. Onderzoekers gebruiken het, net als testosteronpropionaat, als standaard-anabool om de relatieve activiteit van andere anabolen aan te duiden.
De A-ring van methyltestosteron is dezelfde als die van testosteron. Dezelfde metabole omzettingen die bij testosteron kunnen optreden kun je verwachten bij methyltestosteron. Methyltestosteron kan dus goed aromatiseren en heeft dan de bijwerkingen van het overeenkomstige methylestradiol. Gebruikers kunnen erdoor vetweefsel aanzetten, vocht vasthouden en gynaecomastia ontwikkelen. Methylestradiol is hierin actiever dan estradiol zelf.
Het enzym 5a-reductase kan methyltestosteron omzetten in methyldihydrotestosteron (mestanolon, zie Groep 5). Dat steroid veroorzaakt androgene bijwerkingen.
De verhoogde levertoxiciteit van 17a-methylsteroïden is al een aantal keren genoemd en gebruikers moeten dat ook bij methyltestosteron niet onderschatten. [6] [7]
Het anabole steroid methandriol heeft redelijke anabole eigenschappen. Aromatisering treedt bij methandriol minder snel op en ook reductie tot de dihydro-variant is niet direct aan de orde. Dat komt omdat een 3b-HSD-enzym eerst de hydroxylgroep op C3 moet oxideren en de dubbele binding moet isomeriseren, op dezelfde manier als bij DHEA. Pas daarna kan aromatisering of reductie optreden. Methandriol heeft daardoor niet veel bijwerkingen. Als deze beide enzymatische omzettingen plaatsvinden, krijgen we methyltestosteron en dat is inderdaad een metaboliet van methandriol. De bijwerkingen van methyltestosteron kunnen daarom hier ook optreden, maar in mindere mate. De 3-propionaat- en de 3,17-dipropionaat-esterderivaten van methandriol zijn ook in de handel gebracht. Volgens tests heeft het 3-propionaat een redelijke anabole activiteit. [8]
Al vroeg zijn vergelijkende studies uitgevoerd naar de verhouding tussen de anabole en androgene activiteit van populaire anabole steroïden. We geven hier een paar tabelletjes met de resultaten van die studies in ratten als proefdieren. [9] Deze resultaten geven een indicatie van de activiteiten van die anabolen in mensen. We moeten de uitkomsten met enige reserve hanteren.
Ratio anabool : androgeen |
|
17a-methyl-4-chloortestosteron (clostebol) |
5.4 : 2.7 |
17a-methyl-5-androsteen-3,17-diol (methandriol) |
1.1 : 0.7 |
17a-methyl-19-nortestosteron (methylnortestosteron) |
4.2 : 5.3 |
1-methylandros-1-enolon-acetaat (primobolan) |
0.004 : 4.8 |
Dit onderzoek bevestigt de relatief bescheiden anabole activiteit van methandriol. Die was ook al vastgesteld in eerdere studies. Dat geldt ook voor de verhouding tussen anabole en androgene activiteit, die rond de 1 ligt. [10] Uit een humane studie blijkt dat methandriol een relatief zwak anabool is dat geen klinische voordelen biedt boven testosteronpreparaten. [11]
Een Brits patent uit 1961 noemt voor het eerst de goede anabole activiteiten van 7-methyl-androstenen. [12] De extra C7-methylgroep in bolasteron en calusteron vergroot het oppervlak van het molecuul waardoor het goed bindt met de androgeen receptor. De 7a-methylgroep in bolasteron wijst recht naar onderen en beschermt zo de D4-dubbele binding tegen reductie door het enzym 5AR. De groepen in de actieve holte van het enzym die deze reactie moeten uitvoeren, kunnen de dubbele binding moeilijk van onderen naderen, waardoor de reductie naar een 7a-methyldihydrotestosteron-analoog niet optreedt. De 7b-methylgroep ligt horizontaal, meer in het vlak van het steroidskelet, en hindert de reductie minder.
De anabole en androgene eigenschappen van vooral bolasteron zijn in de zestiger jaren van de vorige eeuw onderzocht en vergeleken met die van andere anabole steroïden.
Ratio anabool : androgeen |
|
7a,17a-dimethyltestosteron (bolasteron) |
4.2 : 1.3 |
7a,17a-methyl-4-hydroxytestosteron (oxymesteron) |
1.8 : 0.36 |
7a,17a-methyl-androstanolon (mestanolon) |
0.8 : 1.0 |
9a-fluoro-11b-hydroxy-17a- |
3.8 : 1.4 |
In 1964 meldde Upjohn dat volgens proeven met ratten bolasteron een krachtiger oraal beschikbaar anabool is dan methandrostenolon, oxymetholon of enig ander tot dan toe bekend steroid [14], met een gunstige anabole/androgene verhouding. [15]
Over fluoxymesteron of halotestin is in 1956 voor het eerst gepubliceerd. [16] De goede orale anabole en androgene activiteit van de 11b-hydroxy-, de 11b-hydroxy-9a-fluor- en de 11-keto-9a-fluor-steroïden zijn toen al opgemerkt. In een latere publicatie is geconcludeerd dat de anabole activiteit van fluoxymesteron vergelijkbaar is met die van methyltestosteron en testosteronpropionaat. [17] Gebruikershandleidingen zijn niet erg positief over de anabole kwaliteiten van fluoxymesteron en noemen vooral de hoge androgene activiteit. De handleidingen bevelen halotestin dan ook niet aan.
Thiomesteron (protabol) is door Duchaine gekarakteriseerd als een moeilijk te verkrijgen steroid dat hij nooit heeft kunnen vinden. [1] Het is voor het eerst door Merck gemaakt en getest in 1964. Merck beschreef protabol als een verbinding met uitstekende anabole activiteit en met weinig bijwerkingen. [18] [19]
Hieronder geven we ook nog een tabel waarin meerdere activiteiten van een aantal bekende anabole steroïden met elkaar zijn vergeleken in proeven op ratten. [20] In de studies keken onderzoekers naar de minimale dosis van die anabolen waarbij nog sprake was van een significant effect. Hoe kleiner de benodigde dosis, des te groter is de activiteit van het anabool. De onderzoekers keken naar:
a. het gewichtverlies van de testes als maat voor de remmende invloed op HHT-as (zie Hoofdstuk 20)
b. de gewichtstoename van de spermaproducerende cellen als maat voor androgene effecten
c. de gewichtstoename van de prostaat als tweede maat voor androgene effecten
d. de gewichtstoename van de kringspier, als maat voor anabole effecten
Testosteron geeft alle effecten bij de laagste effectieve dosis. Het beste is wanneer de anabole effecten optreden bij een lage dosis en de andere effecten pas optreden bij hoge doses. Nandrolonfenylpropionaat, norboleton, bolasteron, norethandrolon, oxymesteron en metenolonacetaat ontlopen elkaar niet veel.
a. |
b. |
c. |
d. |
|
oxymetholon |
100 |
400 |
1000 |
100 |
oxandrolon |
100 |
400 |
1000 |
200 |
methandrostanolon |
100 |
1000 |
1000 |
200 |
nandrolonfenylpropionaat |
< 40 |
100 |
200 |
< 40 |
norboleton |
< 40 |
100 |
200 |
< 40 |
ethylestrenol |
400 |
1000 |
100 |
|
ethylestrenol |
< 40 |
100 |
100 |
< 40 |
norethandrolon |
< 40 |
200 |
400 |
< 40 |
norethandrolon |
< 40 |
200 |
400 |
< 40 |
oxymesteron |
< 40 |
200 |
400 |
< 40 |
metenolon-acetaat |
< 40 |
100 |
200 |
< 40 |
chlorotestosteron-acetaat |
100 |
400 |
2000 |
100 |
testosteron |
< 40 |
< 40 |
< 40 |
< 40 |
stanozolol |
< 40 |
200 |
400 |
< 40 |
Groep 4. 19-Nor-17a-methyl- en 17a-ethyl-androstenen
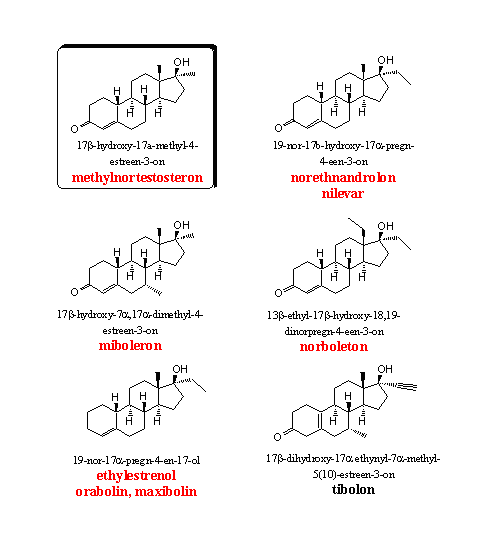
De 19-norsteroïden hebben een goede anabole en een bescheiden androgene activiteit. De 17a-methylsteroïden hebben bovendien een langerdurende orale werking. Het lag daarom voor de hand om steroïden met een combinatie van die twee structuur elementen te synthetiseren en te testen. De farmacie heeft niet alleen 17a-methylanabolen gemaakt, maar ook anabolen met grotere alkylgroepen op C17, zoals ethyl en propyl. Tests hebben uitgewezen dat de methyl- en ethylgroepen de beste resultaten geven en dat bij het langer worden van de ketens de activiteit snel achteruit gaat. [21] [22] Langere ketens vind je dan ook niet in de anabole steroïden die in de handel zijn gekomen. Ook de methylgroep op C18 is wel eens vervangen door langere ketens, en ook hier geven methyl- en ethylgroepen het beste resultaat. Nilevar en het designeranabool norboleton zijn voorbeelden hiervan. In miberolon zit nog een extra 7a-methylgroep die ervoor zorgt dat de 5a-reductie van de D4-dubbele binding niet zal optreden.
Methylnortestosteron en norethandrolon horen bij de groep nor-androstenen. Onderzoekers hebben beide 17a-alkylgesubstitueerde nor-androstenen vaak getest en met elkaar vergelen, en norethandrolon komt steevast als het actiefste anabool uit de bus. Het heeft ook de beste verhouding tussen androgene en anabole activiteit. (Zie de tabellen hierboven.) [23-25]
Onderzoekers hebben ook norboleton in die vergelijkende studies vaak meegenomen. [26] Ze roemen de hoge anabole activiteit en de betrekkelijk geringe androgene activiteit. Later is gebleken dat er toch androgene bijwerkingen kunnen optreden bij het gebruik van dit designersteroid. Norboleton is in Hoofdstuk 18 beschreven.
Miboleron heeft een extra 7a-methylgroep. Een aantal 7a,17a-dimethyl-19-nor-testosteron-analogen zijn begin jaren zestig door Upjohn gesynthetiseerd en getest. [27] [28] De studies vergeleken de activiteit van miboleron met die van fluoxymesteron in proeven op ratten en apen. In een artikel in Steroids is vastgesteld dat in een apenstudie de anabole activiteit van miboleron veertien keer groter is dan die van fluoxymesteron. In aan ander artikel vindt Upjohn in een experiment met ratten voor miboleron een androgene activiteit die veertien keer en een anabole activiteit die 41 keer groter is dan die van methyltestosteron. Datzelfde artikel vermeldt dat de anabole activiteit van miboleron 144 keer groter is dan die van fluoxymesteron.
Onderzoekers hebben zich ook verbaasd over de goede anabole activiteit van steroïden zonder C3-carbonylgroep. Bij de androstanen is desoxymethyltestosteron (DMT, zie Groep 5 en Hoofdstuk 18) een goed voorbeeld, maar er zijn ook desoxy-19-nor-androstanen gesynthetiseerd, getest en gepatenteerd, vooral door Organon. [29] Ethylestrenol is in de handel gebracht als orabolin en als maxibolin. Het is een oraal beschikbaar, mild anabool steroid. Uit de structuur kunnen we afleiden dat ethylestrenol niet kan aromatiseren (geen C3-carbonylgroep en geen C19-methylgroep). Ook 5a-reductie zal niet optreden. Daarvoor is een dubbele binding nodig, die geconjugeerd is met een C3-carbonylgroep - en die laatste ontbreekt hier. Ethylestrenol heeft daarom weinig bijwerkingen.
Tibolon is in het midden van de zestiger jaren door Organon onderzocht en gepatenteerd. [30] Tibolon en zijn metabolieten hebben een brede activiteit als anabool, estrogeen en progestageen. Organon stopt het als actief bestanddeel in Livial, een preparaat voor vrouwen in de overgang. Het is ook een interessant tussenproduct in de synthese van andere steroïden. Recente patenten beschrijven nieuwe syntheses van tibolon.
Groep 5. Dihydrotestosteron-achtige steroiden
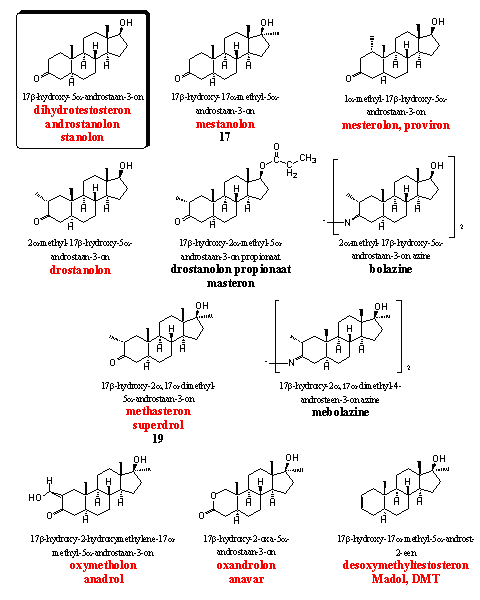
De steroïden in Groep 5 hebben allemaal een 5a-H-atoom. Dit betekent dat deze steroïden niet aromatiseren. Ze missen de D4-dubbele binding. Zonder dat structuurelement kan aromatisering niet plaatsvinden (zie Hoofdstuk 14).
Daar staat tegenover dat veel van deze steroïden serieuze androgene bijwerkingen hebben. Toch is het lastig alle eigenschappen van de steroïden in deze groep te voorspellen. Testen en ervaringsgegevens zijn nodig om uitsluitsel te geven over de verhouding tussen anabole en androgene activiteit. Mestanolon, mesterolon en drostanolon zijn alledrie in de eerste plaats androgenen.
De azines bolazine en mebolazine zijn in begin 1960 in Italie ontwikkeld en gepatenteerd. [31] Mexicaanse onderzoekers vinden een anabole activiteit voor mebolazine die drie keer groter is dan die van testosteronpropionaat. [32] De Italiaanse onderzoekers stellen eveneens vast dat de anabole activiteit van deze azines groter is dan die van methyltestosteron. [33] [34] Wij hebben niet de indruk dat deze steroidderivaten nog ergens te koop zijn.
De derivaten bolazine en mebolazine staan niet op de lijst van de WADA. Wees echter op je hoede. Deze stikstofderivaten hydrolyseren onder de zure omstandigheden in de maag geheel of gedeeltelijk tot respectievelijk drostanolon en methasteron. Dat laatste steroid is beter bekend als superdrol. Die twee anabolen staan wel op de lijst van de WADA en gebruikers van bolazine en mebolazine zullen bij een dopingtest zeker door de mand vallen. Hetzelfde geldt uiteraard voor drostanolonpropionaat (masteron). Esterases zullen in het lichaam drostanolon vrijmaken als werkzaam steroid en dopingjagers kunnen dat steroid daarna opsporen.
De synthese van drostanolon en superdrol is al in 1956 gepubliceerd. [35] Een iets latere publicatie van Syntex beschrijft de synthese van drostanolon, drostanolon-17-propionaat (masteron), superdrol en oxymetholon. [36] De onderzoekers noemen in dat artikel ook de sterke orale anabole activiteit en de relatief geringe androgene activiteit van deze steroïden. Ook latere patenten van Upjohn [37] en het eerder genoemde Italiaanse patent [31] claimen deze steroïden en noemen de aanmerkelijke anabole activiteit. Masteron heeft ondertussen ingeboet aan populariteit en superdrol is zo langzamerhand eerder berucht dan beroemd. De opmerking “geringe androgene activiteit” mag je met een korrel zout nemen. De levertoxiciteit van superdrol is al meerdere keren gesignaleerd. [38])
De bekendste anabole steroïden uit deze groep zijn oxymetholon, oxandrolon en madol (DMT). Ze zijn alle 5a-gereduceerd, maar ze zijn niet erg androgeen en ze hebben goede anabole eigenschappen.
Het is chemisch eenvoudig om een hydroxymethyleengroep in te voeren naast een carbonylgroep. Ook in anabole steroïden is dat gedaan op C2 in ring A, naast de carbonylgroep op C3. Als we dat doen in mestanolon, dan krijgen we oxymetholon. [36] Chemici kunnen daarna de gevormde hydroxymethyleenverbinding op eenvoudige manier omzetten in andere ring A-gemodificeerde steroïden. Die zijn ook gemaakt, getest en in de handel gebracht. In Hoofdstuk 18 hebben we al verteld hoe je van oxymetholon designersteroïden kunt synthetiseren (schema’s 5 en 6). Hieronder doen we dat nog eens.
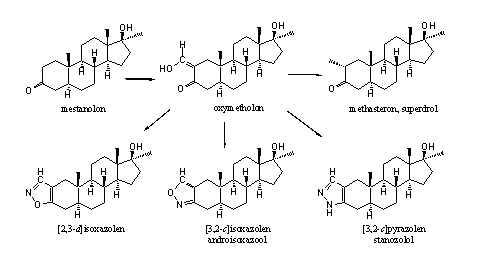
Oxymetholon is een zeer krachtig anabool steroid met een relatief geringe androgene activiteit. Artsen hebben oxymetholon lang gebruikt als medicijn tegen bloedarmoede. Dat stopte met de komst van epo, een effectiever middel met minder bijwerkingen. Het steroid is nog steeds op de markt als medicijn tegen spierdystrofie bij HIV-patiënten.
Gebruikers van oxymetholon rapporteren als bijwerkingen opvallend vaak dat ze vocht vasthouden en gynecomastia ontwikkelen. Dat is op het eerste gezicht merkwaardig, want oxymetholon heeft geen D4-dubbele binding. Oxymetholon kan daarom niet op de normale manier aromatiseren. Pat Arnold en William Llewellyn [39] speculeren dat oxymetholon zelf redelijk goed interacteert met de estrogeenreceptor dankzij de aanwezigheid van de fenol-achtige hydroxylgroep in ring A. In het onderstaande is een mogelijke chemische verklaring voor deze speculatie uitgewerkt.
De hydroxylgroep in methylestradiol zit vast aan een aromatische ring. Het H-atoom van zo’n hydroxylgroep zit tamelijk los aan het zuurstofatoom gebonden. Chemici zeggen dat een hydroxylgroep aan een aromaat, een zogenaamde fenolische hydroxylgroep, een beetje zuur is (gemakkelijk H+ afsplitst). Deze hydroxylgroep is daardoor ook een goede waterstofbrugdonor. Dit is ook het geval met het H-atoom aan de hydroxylgroep van hydroxymethyleen-carbonylverbindingen. In hydroxymethyleen-carbonylverbindingen kan daarnaast tautomerie optreden. Dat wil zeggen dat het H-atoom aan het O-atoom van de hydroxymethyleengroep in een evenwicht kan verhuizen naar het O-atoom van de carbonylgroep. De dubbele bindingen verschuiven dan tegelijkertijd. De situatie in het rechter tautomeer lijkt nog sterker op die in methylestradiol. Dit zou kunnen verklaren waarom oxymetholon zelf kan complexeren met de estrogeenreceptor. We hebben overigens geen literatuur kunnen vinden over de mogelijke binding van oxymetholon met de estrogeenreceptor.
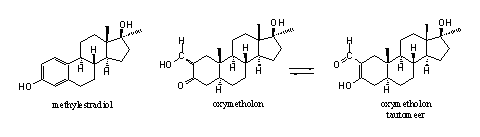
Het is dus zinloos het enzym aromatase te remmen om aromatisering van oxymetholon te verhinderen en zo gynecomastia tegen te gaan. We moeten daarom de estradiolreceptor zelf blokkeren om gynaecomastia door oxymetholon te voorkomen.
Oxandrolon (anavar) is in het begin van de jaren zestig ontwikkeld door Searle. [40] [41] Oxandrolon heeft een ongebruikelijke ring A in het steroidskelet. Het C2-atoom is vervangen door een O-atoom. Dit heeft meer gevolgen dan alleen maar een vervanging van het ene atoom door een ander, want de carbonylgroep op C3 is daardoor veranderd in een ester. Deze esterfunctie zit ingebouwd in ring A en chemici noemen zo’n cyclische ester een lacton. Dit lacton heeft nog steeds een carbonylgroep op C3, die kan functioneren als waterstofbrug-acceptor voor binding met de receptor. Een lacton is echter moeilijker te reduceren dan een carbonylgroep en metabole omzetting (reductie tot een hydroxylgroep) op C3 treedt niet op.
Ring A van oxandrolon kan ook niet aromatiseren. Het O-atoom heeft maar twee bindingsmogelijkheden en die zijn allebei nodig om de ring te vormen. Er is geen plaats meer voor de extra dubbele binding die nodig is om een aromaat te krijgen. De D4-dubbele binding ontbreekt ook - en dat is een tweede reden waarom aromatisering niet optreedt.
De 17a-methylgroep verhindert oxidatie van de 17b-hydroxylgroep en hindert de binding met glucuronzuur of sulfaat. Al met al is oxandrolon dus een anabool dat niet gemakkelijk metaboliseert. Je kunt het anabool daarom slikken als een pil en het verlaat het lichaam na verloop van tijd in onveranderde vorm. [42]
De anabole activiteit van oxandrolon is ongeveer zes keer die van methyltestosteron. [43] [44] Oxandrolon heeft niet veel androgene bijwerkingen. Ook vrouwen kunnen dit steroid in lage doseringen gebruiken, zonder dat ze kans hebben op vermannelijking. Het steroid heeft wel een 17a-methylgroep, maar blijkt in studies niet al te toxisch voor de lever. Oxandrolone is in de VS goedgekeurd door de Food and Drug Administration (FDA) voor HIV-patiënten.
Onderzoekers hebben vastgesteld dat oxandrolon de spiergroei stimuleert in jonge mannen. [45] Ze veronderstellen dat oxandrolon zorgt voor een toename van de androgeenreceptorconcentratie in de spieren. Het anabole effect van oxandrolon is ook bestudeerd in oudere mannen, en het blijkt ook bij die groep goed te werken. [46] In trials bevordert oxandrolon de spiergroei en reduceert vetweefsel. Na stoppen van het gebruik van oxandrolon blijkt het effect op de spiergroei na twaalf weken te zijn verdwenen. De reductie van vetweefsel is echter blijvend.
Het designersteroid madol (DMT) hebben we in Hoofdstuk 18 al uitvoerig besproken. Duitse biochemici hebben onlangs geconstateerd dat madol SARM-achtige eigenschappen (zie ook Hoofdstuk 20) heeft. Madol is ook in voedingsupplementen aangetroffen [47] zonder dat de makers van die supplementen de aanwezigheid van het anabool duidelijk hebben aangegeven.
Groep 6. D1-Testosteron-achtige steroïden
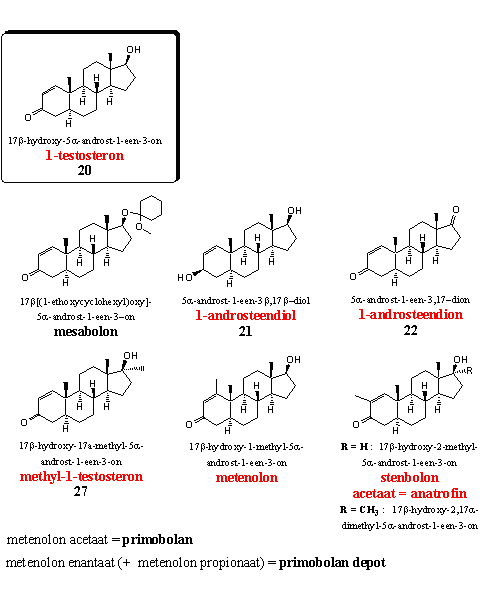
1-Testosteron (steroid 20) is zelf een sterk anabool, maar producenten verkopen het als prohormoon. Het linker steroid op de bovenste rij is een acetaalderivaat van 1-testosteron (zie Hoofdstuk 17). Het hydrolyseert onder de zure omstandigheden in de maag waarschijnlijk tot 1-testosteron. De beide andere steroïden op de bovenste rij zijn prohormonen voor 1-testosteron. Ze zijn in Hoofdstuk 19 als steroïden 21 en 22 behandeld.
Ook methyl-1-testosteron is in Hoofdstuk 19 als steroid 27 aan de orde geweest. Het is een sterk anabool, maar ook te koop als voedingsupplement.
De steroïden met(h)enolon (het wordt zowel met als zonder h geschreven) en stenbolon hebben beide een extra methylgroep aan de D1dubbele binding.
Metenolon - en het beter bekende acetaat (primobolan) en enantaat (primobolan depot) - zijn ontwikkeld en gepatenteerd door Schering in het begin van de jaren zestig. [48] [49] Metenolon en het acetaat (primobolan) behoren tot de beperkte groep oraal actieve anabolen zonder 17a-methylgroep. Het anabool is daardoor niet erg toxisch voor de lever. Gebruikers hebben echter wel een hoge dosering nodig omdat metabole omzettingen wel degelijk optreden, zij het langzamer dan bij testosteron. Het langer werkende enantaat zit in injecteerbare preparaten. Metenolon is een mild anabool met weinig androgene neveneffecten. Het is van oudsher populair bij vrouwen.
Ook stenbolon is geïntroduceerd door Schering - later door Syntex - in het begin van van jaren zestig van de twintigste eeuw. [50] [51] Het acetaat van stenbolon is bekend geworden onder de handelsnaam anatrofin. [51] Het is een mild anabool dat niet aromatiseert met weinig androgene neveneffecten. Er is ook een 17a-methyl variant bekend. [50] [52] Dat is een krachtiger anabool met weinig androgene bijwerkingen maar het is waarschijnlijk wel toxisch voor de lever. Een Amerikaans supplementenbedrijf heeft ooit geclaimd dat het die 17a-methyl als voedingssupplement zou vermarkten.
Groep 7. Androstanen met meerdere dubbele bindingen en derivaten daarvan
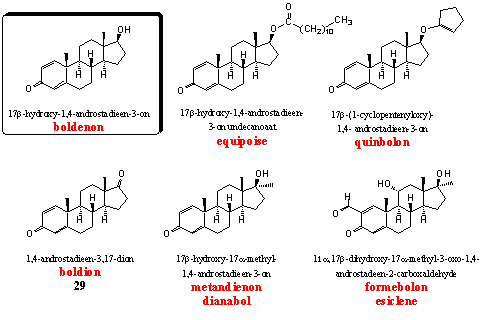
De steroïden in deze groep hebben een extra D1-dubbele binding in ring A die je niet vindt in het testosteronmolecuul. De meest bekende anabolen uit deze groep zijn boldenon en vooral de 17a-methyl-analoog dianabol. Het aanbrengen van dit karakteristieke D1,4-diënonsysteem in ring A was een van de eerste modificaties die chemici in testosteron hebben aangebracht om de werking te verbeteren.
De androgene bijwerkingen van deze steroïden zijn niet groot, mits de doses bescheiden blijven. Wel treedt er in de D1,4-diënonen een zekere mate van aromatisering op. Een mogelijke verklaring daarvoor hebben we al in Hoofdstuk 14 gegeven. Het enzym aromatase is waarschijnlijk alleen betrokken bij de vorming van de hydroxyl- en carbonyl-tussenproducten in de aromatisering. Daarna kunnen deze tussenproducten, dankzij de aanwezigheid van de extra D1-dubbele binding, eenvoudig formaldehyde of mierenzuur afsplitsen onder invloed van hydroxide (OH-), en zo de aromatische ring A vormen. Aromatase is waarschijnlijk niet nodig voor deze laatste stap. Dit mechanisme is speculatief maar het is chemisch gezien goed mogelijk (zie het onderstaande schema).
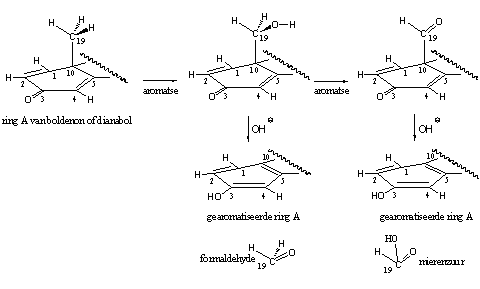
Boldenon zelf en twee derivaten daarvan, equipoise en quinbolon, zijn in het anabolenmilieu bekend. [52]. Equipoise is de injecteerbare undecanoaat-ester van boldenon. De activiteit van equipoise lijkt wel wat op die van decadurabolin, de gelijksoortige nandrolondecanoaat-ester. Equipoise is een mild anabool dat oorspronkelijk is ontwikkeld voor veterinair gebruik. Het undecaanvetzuur waarmee de hydroxylgroep is veresterd maakt het steroidderivaat apolair. Het wordt daardoor na injectie opgeslagen in eveneens apolaire vetweefsels en het blijft lang aantoonbaar in het lichaam, net als nandrolondecanoaat.
Quinbolon is een enol-etherderivaat van boldenon. Het enol-etherstructuur element zit in de vijfring. Enol-ethers zijn niet stabiel in zuur milieu. Gebruik je quinbolon oraal, dan zal in de maag boldenon al vrijkomen door vergaande of gehele hydrolyse van de enol-ether. Quinbolon is het actieve bestanddeel van Anabolicum Vister, een oraal actief preparaat van Italiaanse makelij. [53]
Boldion is gepatenteerd als prohormoon voor boldenon. Een 17b-dehydrogenase kan de carbonylgroep in het lichaam reduceren tot een 17b-hydroxylgroep en boldenon vormen. [54] De drie laatste steroïden zijn alle voorlopers van boldenon. Aangetoond is dat gebruikers van deze steroïden dezelfde metabolieten uitscheiden als na gebruik van boldenon. Dit is een bewijs dat boldenon een tussenproduct en het werkend steroid is. [55] Boldenon is een mild anabool met weinig androgene bijwerkingen. Aromatisering tot estradiol is alleen problematisch bij hoge doseringen.
Dianabol is het 17a-methyl-analogon van boldenon. Het is ontwikkeld door CIBA [18, 25, 52] en èèn van de anabole steroïden met de langste geschiedenis. Krachtsporters gebruikten het al eind jaren vijftig. In de zestiger jaren werd dianabol ook populair in andere sporten. [56, 57] Het is een krachtig oraal actief anabool met volgens dierstudies betrekkelijk geringe androgene bijwerkingen. Aromatisering tot 17a-methylestradiol treedt wel op (zie hierboven). Omdat methylestradiol actiever is dan estradiol, is deze bijwerking in dianabol ook sterker dan in boldenon en zijn derivaten. De 17a-methylgroep maakt dianbol levertoxisch.
Formebolon is een beetje een apart steroid. Het induceert locale ontstekingen in de geïnjecteerde spier, die daardoor opzwelt en groter en voller wordt. Dit effect is vooral zichtbaar in kleinere spieren en houdt ongeveer vijf dagen aan. Bodybuilders gebruikten het om achtergebleven spiergroepen op wedstrijden beter uit de verf te laten komen. [2] Het steroid heeft milde anabole en zwakke androgene eigenschappen. Het is eind zestiger jaren door Italianen gepatenteerd. [58]
Groep 8. De 19-nor- en de 17a-methyl- en ethyl-analoga van steroïden met meerdere dubbele bindingen
De steroïden in deze groep missen allemaal de C19-methylgroep. Dat brengt veel dopingkenners in de verleiding ze te vergelijken met nandrolon. Deze vergelijking gaat mank om verschillende redenen.
In alle steroïden uit deze groep zit een dubbele binding tussen C9 en C11. Die is in nandrolon afwezig. Deze dubbele binding zorgt ervoor dat deze steroïden flexibeler en platter zijn dan de gewone 19-norsteroïden zoals nandrolon. Ze hebben daardoor een betere interactie met de androgeenreceptor en zijn actiever.
De D9,11dubbele binding zorgt er ook voor dat de steroïden uit deze groep niet kunnen aromatiseren. Gynecomastia kan dus niet optreden. Nandrolon kan in principe wel aromatiseren, zij het in beperkte mate.
Het geconjugeerde systeem van dubbele bindingen (afwisselend dubbele en enkele bindingen tussen C4=C5-C9=C10-C11=C12) maakt de D4,5-dubbele binding stabieler en minder gevoelig voor reductie. Het enzym 5a-reductase kan in de daarvoor gevoelige weefsels de D4,5-dubbele binding in de steroïden van deze groep niet reduceren en ze omzetten in minder actieve steroïden. Steroïden uit deze groep hebben daardoor stevige androgene bijwerkingen. In diezelfde weefsels kan 5a-reductase nandrolon wel omzetten in het nauwelijks actieve dihydronandrolon. Nandrolon heeft daardoor minder androgene bijwerkingen.
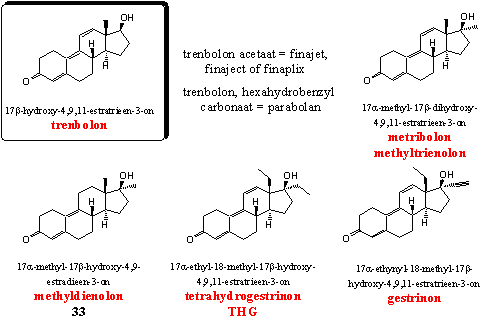
Trenbolon is het sleutelsteroid in deze groep. Het is eind jaren zestig ontwikkeld door Roussel-Uclaf. [59] Trenbolon is van oorsprong een veterinair preparaat maar is ook populair bij bodybuilders. Het is een sterk anabool. Er is al opgemerkt dat trenbolon niet aromatiseert en dat is een groot voordeel in vergelijking met andere sterke anabolen zoals dianabol of testosteron. Trenbolon heeft wel stevige androgene bijwerkingen. Die zorgen echter ook voor meer hardheid en definitie van de spieren, zonder dat gebruikers water vast gaan houden. Het is beschikbaar als een injecteerbaar acetaat en vroeger ook als hexahydrobenzylcarbonaat in het preparaat Parabolan. Esterases zetten deze esterderivaten van trenbolon in het lichaam om in het werkende anabool.
In hetzelfde patent waarin Roussel-Uclaf trenbolon patenteert vind je metribolon (methyltriënolon of methyltrenbolon). [59] Metribolon was lange tijd het sterkste anabole steroid dat we kenden. Het was zo actief dat het moeilijk is de activiteit te vergelijken met die van testosteronpropionaat of methyltestosteron. Studies spreken soms van 30.000 maal zo grote activiteit als die van metyltestosteron. Methyltrenbolon is in de wetenschappelijke wereld . ook bekend onder de code R1881. Onderzoekers gebruiken R1881 vaak om de activiteit van andere anabole steroïden mee te vergelijken. Methyltrenbolon is waarschijnlijk ook het meest toxische steroid voor de lever dat we kennen. Gebruikers van methyltrenbolon zullen gegarandeerd ernstige problemen krijgen.
Methyldiënolon is een sterk anabool steroid met relatief geringe androgene bijwerkingen. De activiteit is veel lager dan die van metribolon maar nog aanzienlijk groter dan die van methyltestosteron. Methyldiënolon is ook in voedingssupplementen aangetroffen en in Hoofdstuk 19 als steroid 33 besproken. [60] [61]
Over THG hoeven we weinig meer te vertellen. Dit designersteroid is in Hoofdstuk 18 aan de orde geweest.
Gestrinon is oorspronkelijk ontwikkeld als oraal anticonceptiemiddel, en midden jaren 60 daarvoor gepatenteerd door Roussel-Uclaf. [62] Het heeft een tamelijk brede activiteit. Artsen gebruiken het voor behandeling van endometriose. Gestrinon vermindert de spermatogenese en het heeft ook milde anabole eigenschappen. Gestrinon staat om die reden op de lijst van verboden steroïden van de WADA. Biochemicus Pat Arnold gebruikte het als grondstof voor de productie van THG (zie Hoofdstuk 18, Schema 2).
Groep 9. Steroïden met een extra hydroxylgroep op C4
Steroïden met een extra hydroxylgroep op C4 zijn ook in Groep 5 van Hoofdstuk 19 besproken. Sommige vertegenwoordigers van deze groep zijn aromataseremmers, andere hebben anabole eigenschappen.
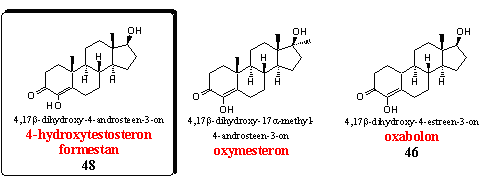
Formestan is het basissteroid in deze groep. In Hoofdstuk 19 is formestan besproken als steroid 48. Het is een krachtige aromataseremmer. [63] [64]
Oxymesteron is het 17a-methyl-analogon van formestan. De anabole eigenschappen zijn al in begin jaren zestig vastgesteld [65] en overtreffen die van methyltestosteron. De androgene eigenschappen zijn juist geringer. De verhouding tussen de anabole en androgene activiteit van formestan is daarom gunstiger dan die van methyltetsosteron.
Oxabolon is het 19-nor-analogon van formestan. In Hoofdstuk 19 is oxabolon genoemd als steroid 46. Het steroid heeft anabole eigenschappen en is geen aromataseremmer. In het Hoofdstuk 19 is al opgemerkt dat de C19-methylgeoxideerde tussenproducten wel eens een rol zouden kunnen spelen in de remming van aromatase (zie ook Schema 2). In 19-norsteroïden zit geen 19-methylgroep en enzymen kunnen die tussenproducten dus ook niet vormen. [66] Oxabolon is in het begin van de zestiger jaren door een Italiaanse groep onderzocht en gepatenteerd. [67] De anabole eigenschappen zijn toen al gesignaleerd. Esters en ethers van deze steroïden zijn later opnieuw gepatenteerd. [68]
Groep 10. Chloorbevattende steroïden
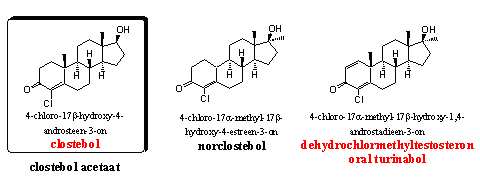
Clostebol-acetaat is een mild anabool steroid dat je oraal of per injectie kunt toedienen. Clostebol heeft een goede verhouding tussen anabole en androgene activiteit, het heeft weinig androgene bijwerkingen. Het steroid aromatiseert niet en is niet toxisch voor de lever. Artsen hebben het voorgeschreven aan vrouwen en ouderen.
Norclostebol is eveneens een mild anabool met weinig androgene bijwerkingen. Clostebol en norclostebol zijn ontwikkeld door het Italiaanse Lab. Farmitalia Milan midden jaren vijftig, [69] maar ook Symtex heeft er in die tijd aan gewerkt. [70]
Oral Turinabol is bekend en berucht geworden als het anabool dat de vroegere DDR aan sporters gaf, of ze dat nu wilden of niet. Chemici hebben al in het begin van de jaren zestig over oral-turinabol gepubliceerd, en de goede anabole en geringe androgene eigenschappen beschreven. [71] [72] Later, nadat het misbruik in de DDR aan het licht is gekomen, is het metabolisme van oral-turinabol in de mens beter onderzocht. [73] Na de val van de muur is oral-turinabol verdwenen, maar dankzij Chinese producenten en ondergrondse werkplaatsen is het anabool inmiddels weer aanwezig op de zwarte markt.
Groep 11. Steroïden met een heterocyclische ring aan ring A
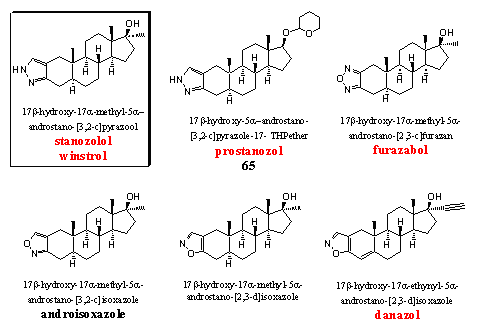
Steroïden met een heterocyclische ring aan ring A zijn eind vijftig en begin jaren zestig uitgebreid onderzocht door Sterling-Winthrop. [74] [75] Stanozolol is het bekendste anabool van deze groep. In de meeste van deze steroïden zit geen D4-dubbele binding die aromatisering mogelijk maakt. Deze steroïden hebben wel aanzienlijke androgene bijwerkingen.
Stanozolol was lange tijd een bekend en gewild anabool steroid, [74] maar het is wereldberoemd geworden toen de honder meterkampioen Ben Johnson betrapt werd op het gebruik op de Olympisch spelen van Los Angeles in 1988. Johnson zelf bekende later overigens dat hij weliswaar anabolen gebruikte, maar ontkende dat hij stanozolol slikte. Hij zou furazabol hebben gebruikt. [Zie onder] Stanozolol is een werkzaam anabool dat je zowel oraal als per injectie kunt nemen. De activiteit is beter dan die van methyltestosteron maar minder dan die van dianabol. De verhouding tussen anabole en androgene activiteit is door meerdere groepen op verschillende manieren onderzocht, en de uitkomsten lopen nogal uiteen. Een gemiddelde van ongeveer 6 geeft echter aan dat deze verhouding gunstig is. Stanozolol is volgens medische handleidingen in lage dosering ook geschikt voor vrouwen.
In prostanozol is dezelfde pyrazoolring verbonden aan ring A als in stanozolol, maar de 17a-methylgroep ontbreekt. Prostanozol is te koop als voedingsupplement en advertenties omschrijven prostanozolol als een prohormoon. Dat is het niet, het is een derivaat van een gewoon anabool steroid waarvan de activiteit vergelijkbaar is met die van stanozolol. De 17-hydroxylgroep is hier beschermd als een THP-ether. Zonder deze ether is het steroid niet oraal actief. [74] Onlangs betrapten dopingjagers een Olympische medaillewinnaar op het gebruik van prostanozol.[76]
Furazabol is een heterocyclisch steroid uit Japan. [77] Het is een betrekkelijk mild anabool met flinke androgene bijwerkingen. Ook van dit heterocyclische steroid is een THP-etherderivaat zonder 17a-methylgroep aangetroffen in voedingssupplementen (zie Hoofdstuk 19, structuur 66).
In androisoxazool is de isoxazoolring op een [3,2-c]-manier verbonden met ring A. Dat betekent dat het N-atoom op de plaats van de C3-carbonylgroep zit. Dit anabool is oraal actief en ongeveer anderhalf maal zo anabool als methyltestosteron maar de androgene activiteit is slechts 20% daarvan. Het heeft dus een gunstige verhouding tussen anabole en androgene activiteit. De anabole activiteit en de verhouding tussen anabole en androgene eigenschappen is echter nog gunstiger als de isoxazoolring op een [2,3-d]-manier aan ring A zit, dus met het O-atoom op de plaats van de C3-carbonylgroep. Dit steroid staat in het midden op de onderste rij maar het staat niet op de WADA lijst, en we hebben ook geen handelsnaam gevonden. De orale anabole activiteit is negen maal zo groot als die van methyltestosteron, terwijl de androgene activiteit vier maal zo klein is. [75]
Rechtsonder in de bovenstaande figuur staat danazol. Bij dat anabool zit de isoxazoolring ook op de [2,3-d]-manier aan ring A. Artsen gebruiken dit steroid wordt voor behandeling van endometriose. Het heeft milde anabole eigenschappen, maar wijlen Dan Duchaine dacht daar anders over. [1] Danazol staat op de lijst van de WADA. Een a-ethynylgroep is meestal niet gunstig voor de anabole activiteit van het betreffende steroid. De anabole activiteit van steroïden met een 17a-methyl- of ethylgroep is doorgaans beter.
Conclusie
De hierboven gepresenteerde anabole steroïden zijn het resultaat van een lange zoektocht van de farmaceutische industrie naar optimaal en selectief werkende steroïden - met hoge activiteit, en een volledige scheiding tussen anabole en androgene werking. Dat doel is tot op de dag van vandaag niet bereikt, maar er zijn wel vorderingen gemaakt. Het inzicht in de factoren die van belang zijn voor zo’n scheiding van effecten is toegenomen, vooral door kristalstructuurbepalingen van het ligandbindende domein van ligand-androgeen receptor complexen (zie Hoofdstuk 7). Dat heeft er ook toe geleid dat veel farmaceutische ondernemingen zijn gaan zoeken naar verbindingen met geheel andere, non-steroidstructuren, de SARMS (Selectieve Androgeen Receptor Modulatoren). De bedrijven hopen dat ze met die middelen wel de gewenste scheiding van anabole en androgene activiteiten bereiken.
Als we terugkeren naar de anabole steroïden, dan kunnen we een aantal globale structuurkenmerken noemen die invloed hebben op de activiteit.
- Testosteron-achtige steroïden. De meest voorkomende variatie is de reductie op C3 en de oxidatie op C17. Beide bewerkingen verlagen doorgaans de activiteit. Aromatisering is bijna onvermijdelijk in deze steroïden, waardoor bijwerkingen als gynaecomastia, vocht vasthouden en vetophoping onvermijdelijk zijn. Reductie van de D4-dubbele binding is ook een normale metabole omzetting. Daardoor ontstaat dihydrotestosteron-achtige steroïden, die vaak een stevige androgene activiteit hebben.
- 19-Nor-androstenen. Het weglaten van de C19-methylgroep heeft vaak een positief effect op de anabole activiteit. Aromatisering treedt op, maar slechts in geringe mate. Reductie van de D4-dubbele binding leidt meestal tot minder actieve steroïden waardoor de kans op androgene bijwerkingen geringer is.
- 17a-Methyl- en -ethyl-androstenen. Het aanbrengen van de C17-methyl- of ethylgroep heeft vaak een klein positief effect op de anabole activiteit. Deze steroïden zijn oraal actief omdat metabole omzettingen niet of vertraagd plaatsvinden. Veranderingen aan C17 hebben relatief weinig invloed op omzettingen in ring A, zodat aromatisering en reductie van de D4-dubbele binding mogelijk blijven en de daarbij horende bijwerkingen geven. In de jaren zestig hebben bedrijven een aantal van zulke steroïden op de markt gebracht, maar die er af gehaald nadat gebruikers leverproblemen ontwikkelden.
- Het weglaten de C19-methylgroep en/of het aanbrengen van een of meerdere methylgroepen op C17, C7, C11 en in mindere mate op C1 en C2 verhoogt meestal de activiteit. Deze zogenaamde stekelvarkensteroïden hebben een groter oppervlak en daardoor een betere Van der Waals-interactie met de androgeenreceptor.
- Dihydrotestosteron-achtige steroïden hebben vaak stevige androgene bijwerkingen, maar dit effect is niet altijd voorspelbaar.
- D1-Testosteron-achtige steroïden. De D1-dubbele binding is vaak gunstig voor de anabole activiteit. Aromatisering is meestal niet mogelijk (dianabol is een uitzondering) en reductie van de D4-dubbele binding treedt niet op. De androgene activiteit van deze steroïden wordt daarom meestal niet gemodificeerd en is soms aanzienlijk.
- Androstenen met meerdere dubbele bindingen. Deze steroïden zijn vlakker en hebben een hoge tot zeer hoge activiteit. Aromatisering treedt niet op. Androgene bijwerkingen zijn soms groot omdat ook hier geen reductie van de D4-dubbele binding plaatsvindt.
- Steroïden met een extra hydroxylgroep op C4. De activiteit van deze steroïden is afhankelijk is van de rest van de structuur.
- Chloorbevattende steroïden. Invoering van een chlooratoom op C4 heeft meestal een verlaging van de anabole activiteit tot gevolg, maar de androgene activiteit vermindert meestal nog meer. Het zijn milde anabolen.
- Steroïden met een heterocyclische ring aan ring A. De anabole activiteit van deze steroïden is vaak wat groter. Deze steroïden aromatiseren niet. Androgene eigenschappen zijn meestal tamelijk sterk.
- Het is nog steeds onvoorspelbaar hoe een combinatie van structuurveranderingen uiteindelijk uitwerkt in de activiteit en selectiviteit van een steroid. Wie wil weten hoe een steroid werkt, moet hem testen. Niet zelden zal ervaringskennis superieur zijn aan wetenschappelijke kennis.
[1] Duchaine D. Underground steroid handbook.
[2] Llewellyn W. Anabolics 2002.
[3] World Anti-Doping Agency (WADA) The 2007 prohibited list.
[4] Solveig H. and Hemmersbach P. Kjemi (2006) 66, 8-12.
[5] Bricout V. and Wright F. European Journal of Applied Physiology (2004) 92, 1-12.
[6] Velazquez I. and Alter B.P. American Journal of Hematology (2004) 77, 257-267.
[7] Koller M. and Ercoli A. Bollettino - Societa Italiana di Biologia Sperimentale (1952) 28, 1726-1729.
[8] De Ruggieri P. and De Giuseppe L. Il Farmaco; edizione scientifica. (1953) 12, 703-705.
[9] Arnold A. and Potts G.O. Acta Endocrinologica (1966) 52, 489-496.
[10] Saunders F.J. and Drill V.A. (searle) Proceedings of the Society for Experimental Biology and Medicine (1957) 94, 646-649.
[11] Partridge J.W.; Boling l.; de Wind L.; Margen S and Kinsell L.W. Journal of Clinical Endocrinology and Metabolism (1953) 13, 189-202.
[12] Brits patent GB 863662.
[13] Arnold A.; Potts G.O. and Beyler A.L. Journal of Endocrinology (1963) 28, 87-92.
[14] Stucki J.C.; Duncan G.W. and Lyster S.C. (Upjohn) Hormonal Steroids, Proceedings of the International Congress on Hormonal Steroids (1965) 2, 119-132.
[15] Campbell J.A. and Babcock J.C. (Upjohn) Hormonal steroids, Proceedings of the International Congress on Hormonal Steroids (1965) 2, 59-67.
[16] Herr M.E.; Hogg J.A. and Levin R.H. (Upjohn) Journal of the American Chemical Society (19560 78, 500-501.
[17] Marinosci A.; Peruzy A.D.; De Martino C. and Sabella G. Folia Endocrinologica (19600 13, 113-140.
[18] Kraft H.G. and Bruecker K. Artzneimittel Forschung (1964) 14, 326-330.
[19] Kraft H.G. and Kieser H. Artzneimittel Forschung (1964) 14, 330-335.
[20] Boris A.; Stevenson R.H. and Trmal T. Steroids (1970) 15, 61-71.
[21] Perrine J.W. Acta Endocrinologica (1961) 37, 376-384.
[22] Colton F.B. (Searle) US patent 2721871.
[23] Drill V.A. and Saunders F.J. (Searle) Hormones and aging process. Proc. Conf Harriman, New York (1955) 99-113.
[24] Overbeek G.A. and de Visser J. Ann. Endocrinol. (Paris) (1956) 17, 268-269.
[25] Dorfman R.I. and Kincl F.A. Endocrinology (1963) 72, 259-266.
[26] R.A. Edgren (Wyeth Labs) Acta Endocrinologica (1963) 87, 21.
[27] Campbell J.A.; Lyster S.C.; Duncan G.W. and Babcock J.C. Steroids (1963) 1, 317-324.
[28] Lyster S.C. and Duncan G.W. Acta Endocrinologica (1963) 43, 399-411.
[29] Szpitlfogel S.A. and cooperators patenten GB 811961 (1959), NL 89813 (1958), GB 91082 (1959), NL 95799 (1960) and US 3112328 (1963).
[30] Organon NV Dutch patent NL 6406797.
[31] Ruggieri P. de Italian patent IT 199611123 and IT 19630403.
[32] Vazques E.; Hinojosa C.; Guevara G.; Guerrero A.; Bruciaga V.; Llaca V.; Velasco S.; Vazques P. and Ortega L. Ginecologia y Obstetricia de Mexico (19630) 18, 549-567.
[33] Matscher R.; Lupo C. and Ruggieri P. de Bollettino- Societa di Biologia Sperimentale (1962) 38, 988-990.
[34] Ruggieri P. de; Gandolfi C. and Chiaramonti O. Bollettino- Societa di Biologia Sperimentale (1962) 38, 985-987.
[35] Ringold H.J. and Rosenkranz G, Journal of Organic Chemistry (1956) 21, 1333-1335.
[36] Ringold H.J.; Batres E.; Halpern O. and Necoechea E. (Syntex) Journal of the American Chemical Society (1959) 81, 427-432.
[37] Babcock J.C.; Campbell J.A. and Pederson R.L. (Upjohn) Danish patent DE 1117114.
[38] Ergogenics.
[39] Llewellyn W. Anabolics 2002, p. 48.
[40] Pappo R. (Searle, 1964) DE 1171425 (Priority US 19600517).
[41] Pappo R. and Jung C. US patent 3101349.
[42] Fennessey P.V.; Gotlin R.W.; Martin D.; Smith S. and Harrison L.M. Journal of Pharmaceutical and Biomedical Analysis (1987) 6, 999-1002.
[43] Fox M.; Minot A.N. and Liddle G.W. Journal of Clinical Endocrinology and Metabolism (1962) 22, 921-924.
[44] Lennon H.D. and Saunders F.J. Steroids (1964) 4, 689-697.
[45] Sheffield-Moore M.; Urban R.J.; Wolf S.E.; Jiang J.; Catlin D.H.; Herndon D.N.; Wolfe R.R. and Ferrando A.A. Journal of Clinical Endocrinology and Metabolism (1999) 84, 2705-2711.
[46] Schroeder E.T.; Zheng L.; Yarasheski K.E.; Qian D.; Stewart Y.; Flores C,; Martinez C.; Terk M. and Sattler F.R. Journal of Applied Physiology (2004) 96, 1055-1062.
[47] Zie Ergogenics.
[48] Weichert R. and Goedicke V. (Schering A.-G.) German patent DE1152103.
[49] Weichert R. and Caspar E. Chemische Berichte (1960) 93, 1710.
[50] Counsel R.E.; Klimstra P.D. and Cotton F.B. J. Org. Chem. (1962) 27, 248.
[51] Kincl F.A. and Dorfman R.I. Steroids (1964) 3, 109.
[52] Nutting E.F.; Klimstra P.D. and Counsel R.E. Acta Endocrinologica (1966) 53, 627 and 635.
[53] Ercoli A.; Gardi R. and Vitali R. Chemistry and Industry (London) (1962) 1284.
[54] Llewellyn W.C. US patent 2003 nr 641528.
[55] Galetti F. and Gardi R. Steroids (1971) 18, 39-50.
[56] Todd T. Journal of Sport History (1987) 14, 87-107.
[57] Fair J.D. Journal of Sport History (1993) 20, 1-24.
[58] Laboratorio Prodotti Braglia, British patent (1969) nr GB 1168931; French patent (1969) nr FR 6061.
[59] Vignau R.; Bucourt R.; Tessier J.;Costerousse G.; Nedelec L.; Gasc J-C.; Joly R.; Warnant J. and Goffinet B. Roussel UCLAF US patent 3 453 267.
[60] Perelman M.; Farkas B.; Fornefeld E.J.; Kraay R.J. and Rapala R.T. Journal of the American Chemical Society (1960) 82, 2402-2403.
[61] Nutting E.F. and Calhoun D.W. Searle Endocrinology (1969) 84, 441-442.
[62] Roussel-Uclaf Nederlands patent NL 6607609; German patent DE 1593307; British patent GB 1069709; French patent FR 1503984.
[63] Marsh D.A.; Brodie H.J.; Garrett W.; Tsai-Morris C,H,en Brodie A.M.H. Journal of Medical Chemistry (1985) 28, 788-795.
[64] Rowlands M.G.; Foster A.B.;Mann J.;Pietrzak B.;Wilkinson J. and Coombes Steroids (1987) 49, 371-382.
[65] Dorfman R.I. and Kincl F.A. Endocrinology (1963) 72, 259.
[66] Covey D.F. and Hood W.F. Molecular Pharmacology (1982) 21, 173-180.
[67] Camerino B.; Patelli B. and Seiaky R. Italian patent 19610210, US patent 3068247.
[68] Sal A. US patent 2003199466, US patent 2004002483.
[69] Sala G.; Baldratti G.; Ronchi R.; Clini V. and Bertazolli C. Sperimentale (1956) 106, 490-510.
[70] Ringold H.J.; Batres E.; Mancera O. and Rosenkranz G. (Syntex) Journal of Organic Chemistry (1956) 21, 1432-1435.
[71] Schubert A.; Stachowiak D.; Onken D.; Specht K.; Barnikol-Oetler K.; Bode E.; Heller K.; Polnert S Schwartz S and Zepter R. Pharmazie (1963) 18, 323.
[72] Dorner G.; Stahl F. and Zabel Endocrinologie (1963) 45, 121.
[73] Musshof F.; Daldrup T. and Ritsch M. Journal of Forensic Sciences (1997) 42, 1119-1125.
[74] Clinton R.O.; Manson A.J.; Stonner F.W. Neumann H.C.; Christiansen R.G.; Clarke R.L.; Ackerman J.H.; Page D.F.; Dean J.W.; Dickinson W.B. and Carabateas C. Journal of the American Chemical Society (1961) 83, 1478-1491.
[75] Manson A.J.; Stonner F.W. Neumann H.C.; Christiansen R.G.; Clarke R.L.; Ackerman J.H.; Page D.F.; Dean J.W.; Phillips D.K.; Potts G.O.; Arnold A.; Beyler A.L. and Clinton R.O. Journal of Medicinal Chemistry (1963) 6, 1-9.
[76] Ergogenics.
[77] Shimizu M.; Ohta G.; Veno K.; Takegoshi T.; Oshima Y.; Kasahara A.; Onodera T.; Mogi M. and Tachizawa H. Chem. & Pharm. Bull. (Tokyo) (1965) 13, 895.
|
|