Het Anabolenboek
Willem Koert
Aede de Groot
Wageningen, 10/5/2007
14. De Werking van Aromatase
Aede de Groot, Willem Koert
Dit hoofdstuk behandelt het werkingsmechanisme van het enzym aromatase. In de hoofdstukken 10 en 11 hebben we aromatase al voorgesteld. In dit hoofdstuk vertellen we waarom welke anabole steroidhormonen aromatiseren – en waarom andere steroidhormonen niet of nauwelijks omzetten in estradiol.
Aromatase is een complex van enzymen met de code cytochroom P450aromatase. Aromatase zet alle anabole steroiden met eenzelfde structuur in ring A als androsteendion of testosteron om in een steroid met een aromatische ring A zoals in estron en estradiol. Om precies te zijn: aromatase katalyseert de oxidatie en de verwijdering van de C19-methylgroep in anabolen met een testosteronachtige structuur in ring A. De C19-methylgroep verlaat het molecuul in de vorm van mierenzuur (zie Schema 1).
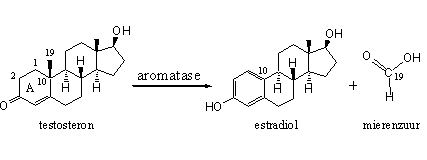
Schema 1
De eerste stap in dit proces is de oxidatie van deze methylgroep (CH3) tot een hydroxymethylgroep (H2C-OH) en daarna tot een formylgroep (HC=O). Daarna vormt het enzym met behulp van zijn co-enzym een 19-hydroxy-19-ferriperoxide-tussenproduct en vindt de splitsing van de C10-C19 binding plaats, en splitst het bH-atoom af van C1.
De enolisatie van de C3-carbonylgroep - daarover later meer - zorgt voor een dubbele binding in de ring en vergemakkelijkt de splitsing van het C1-bH-atoom. Een drijvende kracht is daarbij de vorming van de aromatische ring zie Schema 2).
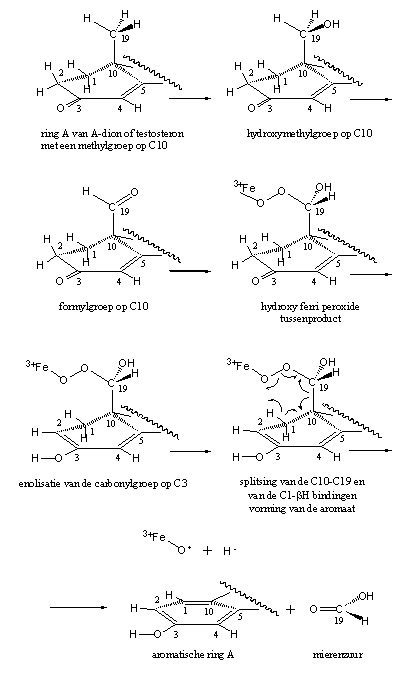
Schema 2
Wil aromatase een A-ring kunnen aromatiseren, dan moet die A-ring drie structuurelementen hebben.
1) Een carbonylgroep op C3.
2) Een D4-dubbele binding.
3) Een C19-methylgroep.
Structuurvoorwaarde 1: een carbonylgroep op C3
Zoals je kunt zien in Schema 2 zorgt enolisatie van de C3-carbonylgroep voor een dubbele binding in de ring en vergemakkelijkt het tegelijk de afsplitsing van het bH-atoom van C1. Voordat we uitleggen waarom moeten we eerst vertellen wat een enol en enolisatie precies zijn.
Een enol is een combinatie van een dubbele binding en een hydroxylgroep. De naam enol is een samentrekking van de uitgangen voor een dubbele binding (een) en een hydroxylgroep (ol). Enolisatie is een evenwicht tussen de carbonylverbinding 2 (de ketovorm) en het enol 3 (de enolvorm) (zie Schema 3). Het evenwicht ligt normaliter aan de kant van de ketovorm maar er is altijd een beetje van de enolvorm aanwezig.
Enolisatie is een evenwicht dat in alle carbonylverbindingen voorkomt. Het is een evenwicht tussen de carbonylverbinding 2 (de ketovorm) en het enol 3 (de enolvorm) (zie Schema 3).
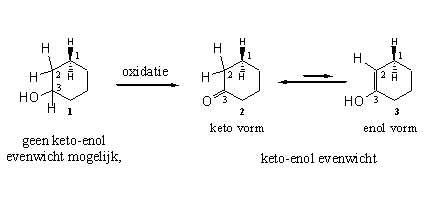
Schema 3
Het keto-enol-evenwicht komt tot stand door de verhuizing van een H-atoom van C2 naar het O-atoom van de carbonylgroep. De dubbele binding C=O verschuift naar C2-C3.
We moeten hier ook opmerken dat een hydroxylgroep op C3 zoals in verbinding 1, niet kan enoliseren. Er is in die verbinding geen dubbele binding aanwezig die kan verschuiven. De hydroxylgroep moet eerst oxideren tot een carbonylgroep, en die kan daarna pas enoliseren.
Door de verschuiving van de dubbele binding in de ring komen de H-atomen aan C1 in een andere situatie terecht. In de ketoverbinding 2 zitten de H-atomen aan C1 geisoleerd van de dubbele binding C=O. C2 zit immers tussen C1 en C3. In de enolverbinding 3 zit C1 direct naast de dubbele binding C=C. Die positie naast een dubbele binding maakt de H-atomen aan C1 reactiever en gemakkelijker af te splitsen.
Structuurvoorwaarde 2: een D4-dubbele binding
Een aromatische ring heeft drie dubbele bindingen. Aromatase maakt alleen de C1-C10-dubbele binding. Door enolisatie ontstaat de C2=C3-dubbele binding. De derde dubbele binding moet al in de ring aanwezig zijn. Daarom is de D4-dubbele binding nodig om de A-ring drie dubbele bindingen te geven.
Structuurvoorwaarde 3: een C19-methylgroep
Als de C19-methylgroep afsplitst, splitst ook het bH-atoom van C1 af. Zo ontstaat de dubbele binding aan de bovenkant van de A-ring.
Op basis van de drie structuurvoorwaarden voor aromatisering hebben chemici anabole steroiden ontwikkeld die niet of moeilijk kunnen aromatiseren. We behandelen ze hieronder.
Steroiden zonder D4-dubbele binding
Door het verwijderen of verplaatsen van de D4-dubbele binding kunnen anabole steroiden niet meer aromatiseren. Dat is gebeurd met de steroiden in figuur 1.
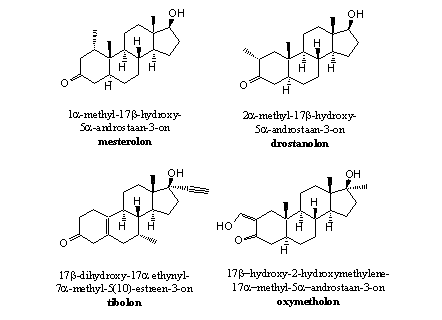
Figuur 1
Je krijgt natuurlijk wel een ander steroid als je de D4-dubbele binding weglaat. In het geval van testosteron krijg je dihydrotestosteron. Dihydrotestosteron heeft een ongewenste androgene activiteit. Het is niet altijd duidelijk of het weglaten van de D4-dubbele binding in andere anabole steroiden een vergelijkbare verschuiving van anabole naar androgene activiteit veroorzaakt.
Nadeel van het weglaten van de D4-dubbele binding is dat de carbonylgroep daardoor makkelijker reduceert tot een hydroxylgroep. Verbindingen met een hydroxylgroep op C3 zijn vaak minder actief, en kunnen gemakkelijker binden met glucuronzuur of sulfaat.
Steroiden zonder C3-carbonylgroep
Er zijn niet zoveel anabole steroiden zonder C3-carbonylgroep op de markt gekomen. De carbonylgroep is immers een waterstofbrug-acceptor die bijdraagt aan een goede binding van het anabool met de receptor. Bolenol en ethylestrenol zijn echter voorbeelden van anabolen zonder carbonylgroep maar met een redelijke anabole activiteit (zie Figuur 2). Verreweg de meeste anabole steroiden hebben echter wel een hydroxylgroep, een carbonylgroep of een andere groep op C3, die met behulp van een waterstofbrug kan bijdragen tot de binding van het anabool aan de receptor (zie Figuren 1, 2 en 3).
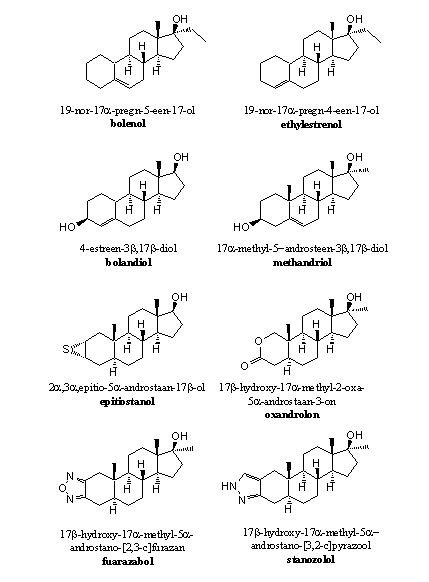
Figuur 2
De C3-carbonylgroep is vervangen door een hydroxylgroep
Een hydroxylgroep kan niet enoliseren. Daardoor zal er een dubbele binding te weinig aanwezig zijn in de A-ring voor het vormen van een aromaat. Daardoor zullen ook de H-atomen op C1 zijn niet geactiveerd voor afsplitsing. De aromatisering kan dus niet plaatsvinden. Voorbeelden van anabolen met een hydroxylgroep op C3 zien we in bolandiol en methandriol (zie Figuur 2).
Voordeel van 3-hydroxyl-anabolen is dat de hydroxylgroep op C3 via waterstofbruggen kan binden met de receptor, al gaat dat wat minder goed dan bij een carbonylgroep. Een dehydrogenase kan een hydroxylgroep natuurlijk oxideren tot een carbonylgroep. Daarna is aromatisering weer mogelijk.
De C3-carbonylgroep is vervangen door een andere groep die niet in de richting van C2 kan enoliseren, maar wel een goede H-brug acceptor is
Deze groepen kunnen toch met een waterstofbrug bijdragen aan een goede binding van het anabool met de receptor. Anabolen zoals epithiostanol (vormt een zwakke waterstofbrug) en oxandrolon omzeilen het aromatiseringsprobleem op deze manier. In deze anabolen is ook de D4-dubbele binding weggelaten. Ook dat zorgt ervoor dat ze niet aromatiseren.
De C3-carbonylgroep is vervangen door een kleine heterocyclische ring
Het aanbouwen van een heterocyclische ring met daarin N- of O-atomen, zoals in furazabol en stanozolol, voorkomt de aromatisering (zie Figuur 2). Deze ringen zijn zelf aromatisch en daardoor tamelijk stabiel. Het N-atoom onderin de ring is een waterstofbrug acceptor en vervult waarschijnlijk die functie in plaats van de carbonylgroep. Ook hier is de D4-dubbele binding afwezig.
De C19-methylgroep is weggelaten
Door het weglaten van die methylgroep kan aromatase niet meer functioneren zoals Schema 2 dat weergeeft. Daardoor kunnen nandrolon en de andere 19-nor-anabolen niet meer aromatiseren (zie Figuur 3).
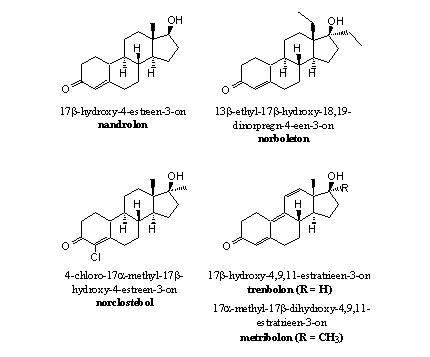
Figuur 3
In principe kan ring A van nandrolon, norboleton of norclostebol wel aromatiseren. Dat gebeurt echter niet door aromatase. Daarvoor moeten andere enzymen dan aromatase een H-atoom van C10 en een H-atoom van C1 verwijderen en vervangen door een dubbele binding. Dat is een dehydrogenering die volgens experimenten met nandrolon inderdaad voorkomt, al gebeurt dat niet in een mate die we kennen van testosteron.
Steroiden met een C1-methylgroep
De methylgroep op C1 belemmert via sterische hinder het verwijderen van het bH-atoom op C1. Daarnaast verkleint het de ruimte waarin het ferri-hydroperoxide-tussenproduct kan ontstaan. Mesterolon is een voorbeeld van zo’n anabool. Als er op C1 helemaal geen H-atoom meer zit zoals in metenolon kan dat natuurlijk ook niet meer afsplitsen (zie Figuur 4).
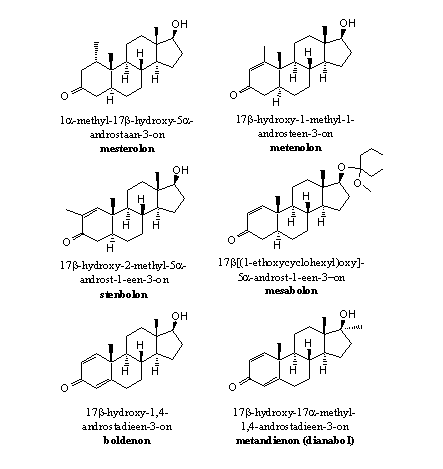
Figuur 4
Steroiden met een D1-dubbele binding
Voorbeelden van dit soort anabole steroïden zijn metenolon, stenbolon en mesabolon. In deze anabolen is aromatisering onmogelijk om geometrische redenen. Als er tussen C1 en C2 een dubbele binding zit, is een dubbele binding tussen C10 en C1 niet meer mogelijk.
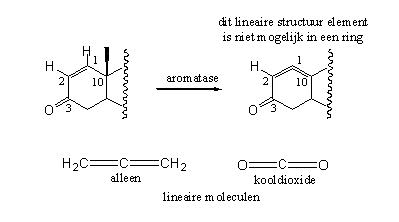
Schema 4
Koolstofverbindingen met twee dubbele bindingen naast elkaar kunnen overigens wel bestaan. Zo’n structuurelement heet een alleen. Een ander molecuul met twee dubbele bindingen aan hetzelfde C-atoom is bijvoorbeeld kooldioxide (zie Schema 4). Zulke moleculen zijn echter lineair, het zijn rechte staven. In een zeshoekige ring, zoals ring A van een steroid, zouden deze twee dubbele bindingen door de vorm van de ring een hoek met elkaar moeten maken van 120o. Die noodzakelijke buiging van het systeem zou zoveel spanning in het molecuul veroorzaken dat dit niet meer bestaanbaar is. Om deze eenvoudige reden beschermt een D1-dubbele binding tegen aromatisering.
De invoering van de D1-dubbele binding creeert ook een geconjugeerd systeem van de dubbele binding met de carbonylgroep. In zo'n systeem reduceert de carbonylgroep minder makkelijk tot een hydroxylgroep. Ook hier is het zo dat de vorm van het molecuul natuurlijk wel verandert door een extra dubbele binding en daarmee mogelijk zijn interactie met de receptor.
Uit experimenten is gebleken dat anabole steroiden met twee dubbele bindingen in ring A zoals boldenon en dianabol toch aromatiseren, zij het niet in de mate als testosteron en methyltestosteron. Ook in deze aromatiseringsreacties speelt het enzym aromatase waarschijnlijk geen of slechts een beperkte rol (zie verderop).
We hebben gezien dat er veel structuuraanpassingen mogelijk zijn om aromatisering te voorkomen. Hoe al die anabolen het aromatase-enzym het hoofd kunnen bieden is onderzocht rond 1960, in proeven met menselijk placentaweefsel [1] [2].
Figuur 5 vat de uitkomsten samen. Het vetgedrukte getal onder de namen van de structuren geeft de relatieve reactiviteit aan van de steroiden in deze enzymatische aromatiseringsreactie. De reactiviteit van 4-androsteen-3,17-dion (A-dion) (1), het natuurlijke substraat van het enzym aromatase, is op 100 gesteld. Aan de hand van de uitkomsten kunnen we nagaan of de hierboven genoemde chemische maatregelen tegen aromatisering werken.
- Verbinding 3 is het eerste tussenproduct in de aromatiseringsreactie (zie Schema 2). De eerste stap in de oxidatie van de C19-methylgroep is hier dus al gedaan. Die stap is meteen de lastigste. Het is niet verrassend dat aromatase deze verbinding snel aromatiseert.
- De goede reactiviteit van verbinding 4 (DHEA) in de aromatisering is ook verwacht. DHEA is een natuurlijk tussenproduct in de biosynthese van estron en het wordt in dit testsysteem waarschijnlijk gewoon gemetaboliseerd, eerst tot A-dion en vervolgens tot estron.
- De invloed van extra hydroxylgroepen op de aromatisering is lastiger te verklaren. Een 11a-hydroxylgroep (verbinding 5) is kennelijk geen bezwaar. De 2b- en 6b-hydroxylgroepen (verbindingen 6 en 7) geven slechts 15 en 20 procent aromatisering. Als de hydroxylgroep op 2a, 1a of 11b zit (verbindingen 8, 9 en 10) dan treedt er helemaal geen aromatisering meer op. Wij hebben geen verklaring voor deze grote verschillen in reactiviteit tussen deze verbindingen. In principe kunnen ze allemaal aromatiseren omdat de daarvoor vereiste structuurelementen in ring A aanwezig zijn.
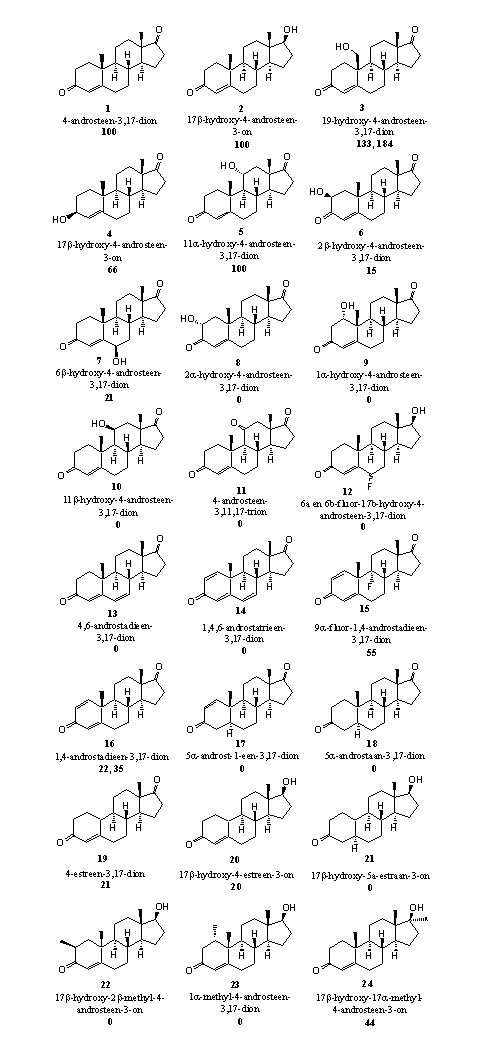
Figuur 5
Ook voor het niet aromatiseren van verbindingen 11 en 12 kunnen we geen verklaring bedenken.
- Een extra dubbele binding op C6 is kennelijk een bezwaar. In de verbindingen 13 en 14 treedt immers geen aromatisering op.
- Er treedt wel een redelijke mate van aromatisering op in de D1,4-verbindingen 15 en 16. Een mogelijke verklaring is dat de aromatisering hier via een ander mechanisme verloopt. De organische chemie kent een reactie die optreedt in de hydroxyl- en carbonyl-tussenproducten van de aromatisering. Deze reacties zijn weergegeven in schema 5. Daar zie je dat voor deze reactie het aan ijzer gebonden zuurstof niet meer nodig is. In de linker kolom zie je dat de hydroxylverbinding, onder invloed van hydroxide (OH-), formaldehyde af kan splitsen onder aromatisering van ring A. In de rechter kolom kan iets vergelijkbaars optreden met een carboxylgroep. Daar kan gemakkelijk mierenzuur afsplitsen onder invloed van hydroxide (OH-). Het voorgestelde mechanisme is speculatief, maar chemisch gezien goed mogelijk.
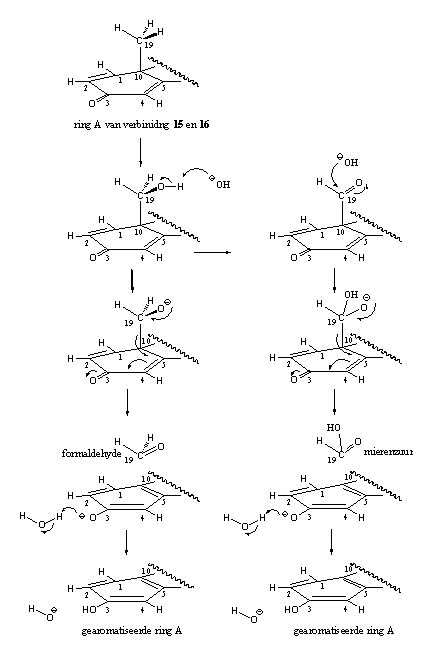
Schema 5
- Het is logisch dat de verbindingen 17 en 18, waarin de dubbele binding op C4 ontbreekt, niet aromatiseren.
- Verrassend is wel dat de nandrolonverbindingen 19 en 20 wel aromatiseren. In principe is dat natuurlijk mogelijk want we kunnen twee H-atomen van C10 en C1 verwijderen onder vorming van een dubbele binding tussen C10 en C1. Na enolisatie van de carbonylgroep op C3 ontstaat dan een aromaat. Het is waarschijnlijk dat het aromatase niet bij deze omzettingen is betrokken.
- Het is geen verrassing dat aromatisering niet optreedt in verbinding 21. Ook hier ontbreekt de dubbele binding op C4.
- Extra methylgroepen aan ring A, zoals in verbindingen 22 en 23, geven kennelijk voldoende sterische hinder om aromatisering te voorkomen. Het steroid past niet meer goed in de reactie holte van het enzym en hinderen de groepen die de reactie moeten katalyseren. Als de extra methylgroep verder weg zit aan C17, zoals in verbinding 24, kan wel weer aromatisering optreden. Ring A in methyltestosteron 24 is chemisch gelijk aan ring A in testosteron. De aromatisering vindt op dezelfde manier plaats als in testosteron.
Het is duidelijk dat er toch wel haken en ogen zitten aan voorspellingen van het gedrag van anabolen, alleen gebaseerd op hun chemische structuur. Er zijn altijd biologische proeven nodig om die voorspellingen te controleren in levende systemen.
[1] Ryan K.J., J. Biol. Chem. (1959) 234, 268-272.
[2] Gual C., Morato T., Hayano M., Gut M. and Dorfman R.I., Endocrinology (1962) 71, 920-925.
|
|